题目内容
新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下: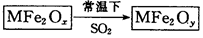
则下列判断正确的是( )
| A.x>y | B.MFe2Ox是还原剂 |
| C.SO2是该反应的催化剂 | D.SO2发生了置换反应 |
B
解析试题分析:能使二氧化硫变成硫单质,该物质一定是还原剂,化合价一定是升高的,根椐化合价代数和为零,可知:x>y;SO2是该反应的的还原剂,而不是催化剂,催化剂是反应前后性质和质量不变的;置换反应是一种单质和一种化合物反应生成另外的一种单质和另外的一种化合物,此题中二氧化硫不符合定义。
考点:考查氧化还原反应。

练习册系列答案
相关题目
在反应2Na2O2+2H2O=4NaOH+O2↑中氧化剂和还原剂的质量比为( )
| A.1 :1 | B.2 :1 | C.1 :2 | D.3 :1 |
在一定温度下,1 mol金属铜与足量某浓度的硝酸完全反应,生成NO2和NO的物质的量之比为1:3,则反应过程中转移的电子为
| A.2 mol | B.3 mol | C.4mol | D.5 mo1 |
下列叙述中正确的是
| A.氧化还原反应的实质是元素化合价的升降 |
| B.非金属元素从化合态变为游离态时,该元素一定被氧化 |
| C.氧化剂氧化其他物质时本身一定被还原 |
| D.具有氧化性的物质在反应中一定做氧化剂 |
下列反应中必须加入还原剂才能进行的是
| A.Cl2→Cl- | B.Zn→ Zn2+ | C.H2→H2O | D.CuO→CuCl2 |
根据反应①2FeCl3+2KI=2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是
| A.Fe3+>Cl2>I2 | B.Cl2>I2>Fe3+ | C.I2>Cl2>Fe3+ | D.Cl2>Fe3+>I2 |
对于反应3Br2+6NaOH=5NaBr+NaBrO3+3H2O,以下叙述正确的是
| A.Br2是氧化剂,NaOH是还原剂 |
| B.氧化产物与还原产物的物质的量的比为5∶1 |
| C.Br2既是氧化剂又是还原剂 |
| D.每生成1mol的NaBrO3转移6mol的电子 |
根据表中信息判断,下列选项不正确的是( )
| 序列 | 参加反应的物质 | 生成物 |
| ① | KMnO4 、H2O2 、H2SO4 | K2SO4 、MnSO4…… |
| ② | Cl2 、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4- …… | Cl2 、Mn2+ …… |
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比为1︰2
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4- > Cl2 > Fe3+ > Br2
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH="-574" kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH="-1" 160 kJ·mol-1
下列说法不正确的是( )
| A.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)ΔH="-Q" ,Q>574 kJ·mol-1 |
| B.等物质的量的甲烷分别参加反应①、②,则反应转移的电子数不同 |
| C.若用标准状况下4.48 L CH4还原NO2至N2,放出的热量为173.4 kJ |
| D.若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为1.6 mol |