题目内容
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3 (s) + 3H2 (g)  W (s) + 3H2O (g)请回答下列问题:
W (s) + 3H2O (g)请回答下列问题:
(1)上述反应的化学平衡常数表达式为 。
(2)某温度下反应达平衡时,H2与水蒸气的体积比为3:5,则H2的平衡转化率 。
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
500℃时,固体物质的主要成分为 ;
第二阶段反应的化学方程式为 ;
假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为 。
钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g)
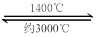 WI4 (g)。下列说法正确的有 。
WI4 (g)。下列说法正确的有 。A.灯管内的I2可循环使用
B.WI4在灯管壁上分解,使灯管的寿命延长
C.WI4在灯丝上分解,产生的W又沉积在灯丝上
D.接通电源后,WI4的分解速率加快,W和I2的化合速率减慢
(1)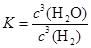
(2)62.5%
(3)WO3、W2O5 W2O5+H2 2WO2+H2O 1∶1∶4
2WO2+H2O 1∶1∶4
(4)A、C
解析试题分析:(1)化学平衡常数是可逆反应达到平衡状态时各生成物浓度幂指数的乘积与各反应物浓度幂指数的乘积的比。对该反应来说,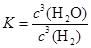 。(2)根据反应方程式可知每产生3mol的H2O,则消耗3mol的H2。若某温度下反应达平衡时,H2与水蒸气的体积比为3:5,消耗的H2是5mol.所以H2的平衡转化率为5÷(5+3)×100%=62.5%。(3)根据表格中的物质与温度的关系可知:在500℃时,固体物质的主要成分为WO3、W2O5。在在第一个阶段发生的反应为:2WO3 (s) +H2 (g)
。(2)根据反应方程式可知每产生3mol的H2O,则消耗3mol的H2。若某温度下反应达平衡时,H2与水蒸气的体积比为3:5,消耗的H2是5mol.所以H2的平衡转化率为5÷(5+3)×100%=62.5%。(3)根据表格中的物质与温度的关系可知:在500℃时,固体物质的主要成分为WO3、W2O5。在在第一个阶段发生的反应为:2WO3 (s) +H2 (g)  W2O5 (s) + H2O (g);在第二阶段反应的化学方程式为W2O5+H2
W2O5 (s) + H2O (g);在第二阶段反应的化学方程式为W2O5+H2 2WO2+H2O;在第三个阶段发生的反应为WO2+2H2
2WO2+H2O;在第三个阶段发生的反应为WO2+2H2 2W+2H2O。若WO3完全转化为W,假设开始有2mol的WO3,则在三个阶段消耗H2物质的量之比为1:1:4。(4)A.在1400℃左右,平衡正向移动;在约3000℃左右,平衡逆向移动。因此在灯管内的I2可循环使用。正确。B.WI4在灯管壁上分解,减少生成物的浓度,平衡正向移动,使灯管的寿命缩短。错误。C.WI4在灯丝上分解,分解产生的W及I2又沉积在灯丝上。正确。D.接通电源后,电能转化为热能,WI4的分解速率加快,W和I2的化合速率也加快。错误。
2W+2H2O。若WO3完全转化为W,假设开始有2mol的WO3,则在三个阶段消耗H2物质的量之比为1:1:4。(4)A.在1400℃左右,平衡正向移动;在约3000℃左右,平衡逆向移动。因此在灯管内的I2可循环使用。正确。B.WI4在灯管壁上分解,减少生成物的浓度,平衡正向移动,使灯管的寿命缩短。错误。C.WI4在灯丝上分解,分解产生的W及I2又沉积在灯丝上。正确。D.接通电源后,电能转化为热能,WI4的分解速率加快,W和I2的化合速率也加快。错误。
考点:考查化学平衡常数的表达式、化学平衡移动及物质的转化率的计算的知识。

Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出上述实验中发生反应的化学方程式: ,该反应是 反应(填放热或吸热)。
(2)实验结果表明,催化剂的催化效果与 有关。
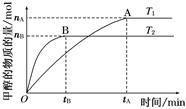
Ⅱ.某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如右图所示,图中数据分析:
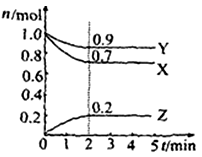
(1)该反应的化学方程式为: 。
(2)反应开始至2min,用Z表示的平均反应速率为: 。
(3)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g) + Y(g) = 2Z(g),当改变下列条件时,反应速率会减小
A.降低温度 B.加入催化剂 C.增大容器体积
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= , △H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,若反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。,则6s时 c(A)= mol·L-1, C的物质的量= mol;
若经一段时间后,反应达到平衡,则此时A的转化率= ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率 ( 填“变大”或“变小”或“不变”);
(3)判断该反应达到平衡的依据为 (填正确选项前的字母):
A.压强不随时间改变
B.气体的密度不随时间改变
C.c(A)不随时间改变
D.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g)
 A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。 在2 L密闭容器内,800℃时反应2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=__________。已知K300℃>K350℃,则该反应是________热反应。
(2)如图中表示NO2变化曲线的是__________,用O2表示从0 s~2 s 内该反应的平均速率v=________。
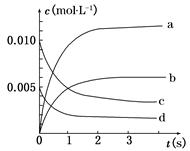
(3)能说明该反应已达到平衡状态的是__________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂

 pC(气) + qD(气)的 C %与时间 t有如图关系
pC(气) + qD(气)的 C %与时间 t有如图关系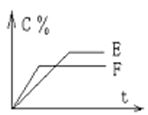
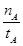 mol·L-1·min-1
mol·L-1·min-1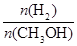 增大
增大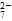 和CrO
和CrO ,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。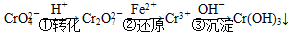
 Cr2O
Cr2O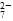 和CrO
和CrO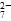 )=v(CrO
)=v(CrO cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了n/2 mol,C增加了3n/2 mol,D增加了n mol。此时反应达到平衡。
cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了n/2 mol,C增加了3n/2 mol,D增加了n mol。此时反应达到平衡。