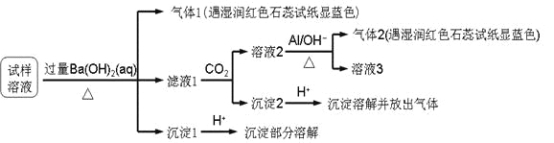
题目内容
【题目】关于氧化还原反应,下列说法不正确的是
A. 氧化反应和还原反应同时发生 B. 一定存在着电子转移
C. 一定存在着元素化合价变化 D. 一定有单质参加反应
【答案】D
【解析】A.在氧化还原反应中氧化反应和还原反应同时发生,故A正确;B.氧化还原反应的本质是有电子转移,故B正确;C.氧化还原反应的特征是有元素化合价的变化,故C正确;D.氧化还原反应中不一定有单质参加反应,如H2O2+SO2=H2SO4就是氧化还原反应,但没有单质参加反应,故D错误;答案选D。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案【题目】锰及其化合物在现代工业和国防建设中具有十分重要的地位。金属锰的提炼方式主要有热还原法和电解法两种,热还原法得到的锰纯度在95-98%之间,电解法得到的锰(简称电解锰),其纯度可达99.7-99.9%以上。
(1)锰锌铁氧体是当前广泛使用的一种隐形涂料,其化学组成为MnxZn1-xFe2O4(铁为+3价),其中当锰锌铁氧体中n(Zn):n(Fe)=2:5时,它对雷达波的吸收能力最强。
① 锰锌铁氧体中锰元素的化合价为_______。
② 当雷达波吸收能力最强时,该物质的化学式为________(改写成氧化物的形式)。
(2)写出以MnO2和Al粉为原料,利用热还原法制备Mn的化学方程式:________.
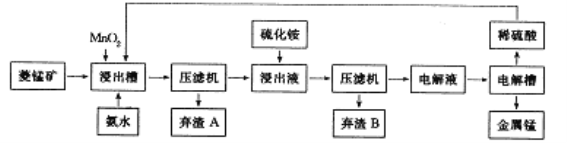
(3)工业上以菱锰矿(主要成分是MnCO3,含有Fe2+、Co2+、Ni2+等杂质金属离子)为原料制备电解锰的流程图如下所示。
生成氢氧化物的pH如下表:
物质 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
开始沉淀时pH | 7.5 | 2.l | 7.7 | 7.6 | 8.3 |
完全沉淀时pH | 9.7 | 3.7 | 8.5 | 8.2 | 9.8 |
① 浸出槽中发生多个反应:如主要成分与硫酸的反应、MnO2与Fe2+间的氧化还原反应等,写出这两个反应的离子方程式:___________________、____________________。
② 加入氨水的目的是为除去杂质,根据流程图及表中数据,pH 应调控在_____范围内。常温下,Ksp[Fe(OH)3]=4.0×10-38,当pH=4时溶液中c(Fe3+)=__________。
③ 加入硫化铵是为除去剩余的Ni2+,反应的离子方程式为____________________。
④ 写出电解硫酸锰溶液制取金属锰的化学方程式:________________________。
【题目】小雨对爸爸给患病的奶奶购买的“便携式制氧器”(图1)产生浓厚的兴趣,他仔细阅读使用说明书,了解了它的工作原理(如图2)和所用的药品.药品中甲剂是一种白色颗粒状固体,作制氧剂;乙剂是黑色固体,作催化剂. 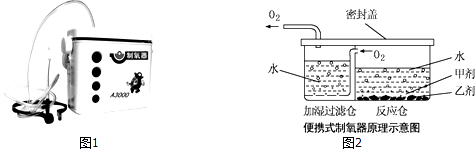
【提出问题】甲剂的化学成分是什么?
【阅资料】过碳酸钠是白色颗粒状固体,溶于水时,生成碳酸钠和过氧化氢,可用于制取氧气.
【设计与实验】小雨把甲剂和乙剂带到实验室与黄老师共同探究.在老师的指导下,验证出甲剂是一种钠盐后,小雨接着进行如下实验:
[实验一]用甲剂和乙剂制取并验证氧气.
(1)根据图2得出:组装气体发生装置时应选择图3所示的仪器:(填字母),该装置还可用于制取的气体是; 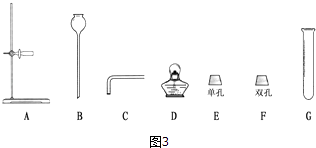
(2)装置连接完毕,装药品前应先检查装置的;
(3)小雨认为氧气是由过氧化氢在乙剂催化下产生的,其化学方程式为;
(4)检验氧气的方法是 . [实验二]检验上述反应后的溶液中是否含有碳酸根离子.
检验步骤 | 实验操作 | 实验现象 | 结论 | |
步骤一 | 取少量反应后的溶液,加入稀盐酸 | 有气泡产生 | ||
步骤二 | 将步骤一产生的气体通入澄清石灰水 | 澄清石灰水变浑浊 |
(5)【实验结论】通过上述实验,小雨得出甲剂是过碳酸钠. 【反思与评价】小方认为小雨的结论不够严密,你认为严密的结论应该是 .