题目内容
(1)明矾常作净水剂,其净水原理用离子方程式可表示为:
(2)常温下,某溶液中由水电离出的c(H+)=10-12mol/L,则该溶液的pH可能为
(3)0.01mol?L-1的下列物质的水溶液:①CH3COOH ②Na2CO3 ③NaHSO4④KOH ⑤H2SO4⑥CuSO4,pH由大到小的关系为
(4)常温下,pH=3的醋酸与pH=11的氢氧化钠溶液等积极混合后,溶液pH
(5)等浓度的下列物质的水溶液:①NH4Cl ②(NH4)2SO4 ③NH4HSO4④NH4HCO3⑤(NH4)2CO3,c(NH4+)由大到小的关系为
Al3++3H2O?Al(OH)3+3H+
Al3++3H2O?Al(OH)3+3H+
用TiCl4水解制备TiO2的化学方程式为:TiCl4+2H2O?TiO2↓+4HCl
TiCl4+2H2O?TiO2↓+4HCl
(2)常温下,某溶液中由水电离出的c(H+)=10-12mol/L,则该溶液的pH可能为
2或12
2或12
;若某溶液pH=4,则该溶液中由水电离出的c(OH-)可能为10-10或 10-4mol/L
10-10或 10-4mol/L
.(3)0.01mol?L-1的下列物质的水溶液:①CH3COOH ②Na2CO3 ③NaHSO4④KOH ⑤H2SO4⑥CuSO4,pH由大到小的关系为
⑤③①⑥②④
⑤③①⑥②④
(用“①②③④⑤⑥”表示)(4)常温下,pH=3的醋酸与pH=11的氢氧化钠溶液等积极混合后,溶液pH
<
<
7,溶液中离子浓度由大到小的关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(5)等浓度的下列物质的水溶液:①NH4Cl ②(NH4)2SO4 ③NH4HSO4④NH4HCO3⑤(NH4)2CO3,c(NH4+)由大到小的关系为
②>⑤>③>①>④;
②>⑤>③>①>④;
(用“①②③④⑤”表示)分析:(1)硫酸铝溶液中含有铝离子,铝离子水解生成氢氧化铝胶体和氢离子,氢氧化铝胶体具有吸附性,所以能净水,水解方程式为Al3++3H2O?Al(OH)3+3H+;TiCl4水解制备TiO2,还生成HCl;
(2)在25℃时,某溶液中,由水电离出的c(H+)水=1.0×10-12 mol/L<10-7mol/L,说明该溶液中的溶质抑制水的电离,溶质能电离出氢离子、氢氧根离子就能抑制水电离,据此分析判断;溶液pH=4,可能是酸也可能是强酸弱碱盐据此分析;
(3)先根据酸碱盐分类,再根据酸中酸的强弱分类,盐中盐的水解呈酸碱性进行分类比较;
(4)pH=3的醋酸中c(H+)=1.0×10-3mol/L,pH=11的氢氧化钠溶液中c(OH-)=1.0×10-3mol/L,醋酸为弱酸,不能完全电离,则c(CH3COOH)>c(NaOH),由于二者体积相等,所以酸过量,溶液显酸性,混合后溶质为CH3COOH和CH3COONa,然后判断离子浓度关系;
(5)①NH4Cl ②(NH4)2SO4 ③NH4HSO4④NH4HCO3 ⑤(NH4)2CO3,先不考虑水解,则②(NH4)2SO4 和 ④(NH4)2CO3 都含有两个NH4+,所以它们NH4+的浓度大于其它三种物质,再根据盐类的水解角度分析解答.
(2)在25℃时,某溶液中,由水电离出的c(H+)水=1.0×10-12 mol/L<10-7mol/L,说明该溶液中的溶质抑制水的电离,溶质能电离出氢离子、氢氧根离子就能抑制水电离,据此分析判断;溶液pH=4,可能是酸也可能是强酸弱碱盐据此分析;
(3)先根据酸碱盐分类,再根据酸中酸的强弱分类,盐中盐的水解呈酸碱性进行分类比较;
(4)pH=3的醋酸中c(H+)=1.0×10-3mol/L,pH=11的氢氧化钠溶液中c(OH-)=1.0×10-3mol/L,醋酸为弱酸,不能完全电离,则c(CH3COOH)>c(NaOH),由于二者体积相等,所以酸过量,溶液显酸性,混合后溶质为CH3COOH和CH3COONa,然后判断离子浓度关系;
(5)①NH4Cl ②(NH4)2SO4 ③NH4HSO4④NH4HCO3 ⑤(NH4)2CO3,先不考虑水解,则②(NH4)2SO4 和 ④(NH4)2CO3 都含有两个NH4+,所以它们NH4+的浓度大于其它三种物质,再根据盐类的水解角度分析解答.
解答:解:(1)硫酸铝溶液中含有铝离子,铝离子水解生成氢氧化铝胶体和氢离子,氢氧化铝胶体具有吸附性,所以能净水,水解方程式为Al3++3H2O?Al(OH)3+3H+;TiCl4水解制备TiO2,根据元素守恒其方程式为:TiCl4+2H2O?TiO2↓+4HCl;
故答案为:Al3++3H2O?Al(OH)3+3H+;TiCl4+2H2O?TiO2↓+4HCl;
(2)在25℃时,某溶液中,由水电离出的c(H+)水=1.0×10-12 mol/L<10-7mol/L,说明该溶液中的溶质抑制水的电离,溶质能电离出氢离子、氢氧根离子就能抑制水电离,则该溶质可能是酸或碱或强酸的酸式盐,如果为酸溶液,则pH=2,如果为盐溶液,则pH=12;溶液pH=4,可能是酸也可能是强酸弱碱盐,若是酸则c(OH-)水=1.0×10-10 mol/L,所以c(H+)水=1.0×10-10 mol/L,若是盐则溶液中氢离子为水电离的,所以c(H+)水=1.0×10-4 mol/L,
故答案为:2或12;1.0×10-10 mol/L或1.0×10-4 mol/L;
(3)酸:硫酸是强酸,在水中完全电离,c(H +)=0.02mol/L,pH<2;
CH3COOH 是弱电解质,所以只有部分电离,故c(H +)<0.01mol/L,所以pH>2;
碱:KOH是强电解质,完全电离,c(OH- )=0.01mol/L,所以pH=12;
盐:Na2CO3是强碱弱酸盐,水溶液都呈碱性,pH>7,但小于同浓度氢氧化钾的pH;
NaHSO4是强酸酸式盐,在水中完全电离成钠离子、硫酸根离子、氢离子,所以C(H +)=0.01mol/L,所以pH=2;
CuSO4强酸弱碱盐,水溶液呈酸性,pH<7,所以pH由小到大的顺序排列的是⑤③①⑥②④,故答案为:⑤③①⑥②④;
(4)pH=3的醋酸中c(H+)=1.0×10-3mol/L,pH=11的氢氧化钠溶液中c(OH-)=1.0×10-3mol/L,醋酸为弱酸,不能完全电离,则c(CH3COOH)>c(NaOH),由于二者体积相等,所以酸过量,溶液显酸性,混合后溶质为CH3COOH和CH3COONa,离子浓度关系为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故答案为:<;c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(5)①NH4Cl ②(NH4)2SO4 ③NH4HSO4④NH4HCO3 ⑤(NH4)2CO3,先不考虑水解,则②(NH4)2SO4 和 ④(NH4)2CO3 都含有两个NH4+,所以它们NH4+的浓度大于其它三种物质,而④(NH4)2CO3 中NH4+水解显酸性,CO32-水解显碱性,两者相互促进,所以NH4+水解的量较多,NH4+的量较少,即溶液中c(NH4+)②>⑤;
①③④三种物质中,③NH4HSO4酸性最强,NH4+水解受到的抑制最大,即NH4+的量较多,溶液中c(NH4+)较大,
④NH4HCO3,NH4+水解与①NH4Cl 比较,水解得到促进,即NH4+的量较少,即溶液中c(NH4+)④<①;
按c(NH4+)由大到小的顺序排列为:②>⑤>③>①>④,
故答案为:②>⑤>③>①>④.
故答案为:Al3++3H2O?Al(OH)3+3H+;TiCl4+2H2O?TiO2↓+4HCl;
(2)在25℃时,某溶液中,由水电离出的c(H+)水=1.0×10-12 mol/L<10-7mol/L,说明该溶液中的溶质抑制水的电离,溶质能电离出氢离子、氢氧根离子就能抑制水电离,则该溶质可能是酸或碱或强酸的酸式盐,如果为酸溶液,则pH=2,如果为盐溶液,则pH=12;溶液pH=4,可能是酸也可能是强酸弱碱盐,若是酸则c(OH-)水=1.0×10-10 mol/L,所以c(H+)水=1.0×10-10 mol/L,若是盐则溶液中氢离子为水电离的,所以c(H+)水=1.0×10-4 mol/L,
故答案为:2或12;1.0×10-10 mol/L或1.0×10-4 mol/L;
(3)酸:硫酸是强酸,在水中完全电离,c(H +)=0.02mol/L,pH<2;
CH3COOH 是弱电解质,所以只有部分电离,故c(H +)<0.01mol/L,所以pH>2;
碱:KOH是强电解质,完全电离,c(OH- )=0.01mol/L,所以pH=12;
盐:Na2CO3是强碱弱酸盐,水溶液都呈碱性,pH>7,但小于同浓度氢氧化钾的pH;
NaHSO4是强酸酸式盐,在水中完全电离成钠离子、硫酸根离子、氢离子,所以C(H +)=0.01mol/L,所以pH=2;
CuSO4强酸弱碱盐,水溶液呈酸性,pH<7,所以pH由小到大的顺序排列的是⑤③①⑥②④,故答案为:⑤③①⑥②④;
(4)pH=3的醋酸中c(H+)=1.0×10-3mol/L,pH=11的氢氧化钠溶液中c(OH-)=1.0×10-3mol/L,醋酸为弱酸,不能完全电离,则c(CH3COOH)>c(NaOH),由于二者体积相等,所以酸过量,溶液显酸性,混合后溶质为CH3COOH和CH3COONa,离子浓度关系为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故答案为:<;c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(5)①NH4Cl ②(NH4)2SO4 ③NH4HSO4④NH4HCO3 ⑤(NH4)2CO3,先不考虑水解,则②(NH4)2SO4 和 ④(NH4)2CO3 都含有两个NH4+,所以它们NH4+的浓度大于其它三种物质,而④(NH4)2CO3 中NH4+水解显酸性,CO32-水解显碱性,两者相互促进,所以NH4+水解的量较多,NH4+的量较少,即溶液中c(NH4+)②>⑤;
①③④三种物质中,③NH4HSO4酸性最强,NH4+水解受到的抑制最大,即NH4+的量较多,溶液中c(NH4+)较大,
④NH4HCO3,NH4+水解与①NH4Cl 比较,水解得到促进,即NH4+的量较少,即溶液中c(NH4+)④<①;
按c(NH4+)由大到小的顺序排列为:②>⑤>③>①>④,
故答案为:②>⑤>③>①>④.
点评:本题考查盐类水解的原理和应用,溶液中离子浓度求算,注意盐类水解的实质和把握弱电解质的电离,从影响平衡移动的角度分析离子浓度的大小比较是解答的关键,题目难度中等.

练习册系列答案
相关题目

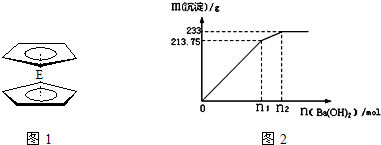
 .核磁共振法能够区分这两种结构.在核磁共振氢谱中,正确的结构有
.核磁共振法能够区分这两种结构.在核磁共振氢谱中,正确的结构有
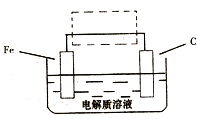 (2010?临沂一模)Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(2010?临沂一模)Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题: