题目内容
下列表述中正确的是( )
| A.任何能使熵值减小的过程都能自发进行 |
| B.1mol NaOH分别和1mol CH3COOH、1molHNO3反应,后者比前者△H小 |
C.已知热化学方程式2SO2(g)+O2(g) 2SO3(g);△H=-Q kJ·mol-1(Q>0),则将2mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量 2SO3(g);△H=-Q kJ·mol-1(Q>0),则将2mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量 |
| D.在Na2SO4溶液中加入过量的BaCl2后,溶液中不存在SO42- |
B
试题分析:A项: 事实上熵变和焓变都不能完全解释自发反应,一般会用吉布斯自由能来判别反应是否可以自发进行,△G=△H-T△S,当△G>0时,反应可逆向进行,△G=0时,反应平衡,当△G<0时反应可正向进行,故A错;
C项:反应为可逆反应,不能进行到底,放出的热量要小于Q kJ,故错;
D项:BaSO4虽是难容物,但也存在溶解平衡,溶液肯定存在较少的SO42-,故错。
故选B。
点评:本题比较典型,全面考查了熵的知识、热化学方程式的书写、△H的计算、离子反应等,仔细研究,定会有所提高。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


 O2(g)===ZnO(s) ΔH1=-Q1 kJ/mol①
O2(g)===ZnO(s) ΔH1=-Q1 kJ/mol①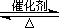 2SO3(g) ?H="-196.6" kJ·mol-1
2SO3(g) ?H="-196.6" kJ·mol-1 2NO2(g) ?H="-113.0" kJ·mol-1
2NO2(g) ?H="-113.0" kJ·mol-1