题目内容
【题目】铁在自然界中的含量丰富,而且在生活生产中应用广泛。
(1)铁在周期表中的位置为______。
(2)硝普试剂[Fe(NO)CN)5]2-可用于检验S2-,两者反应得紫色溶液,其中两个配体互为等电子体,已知硝普试剂[Fe(NO)(CN)5]2-中Fe为+2价,其基态离子的外围电子排布式为_______。
(3)K4[Fe(CN)6]溶液可用于检验Fe3+,K、C、N的第一电离能由大到小的顺序为______,K4[Fe(CN)6]内界中σ键与π键的个数比为______。
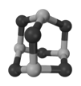
(4)二茂铁是由两个环戊二烯阴离子与Fe2+离子组成的三明治型化合物,即![]() 。环戊二烯分子(
。环戊二烯分子(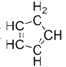 )中碳原子的杂化方式为_______。
)中碳原子的杂化方式为_______。
(5)工业电解熔融的FeO、Fe2O3冶炼高纯铁。FeO与Fe2O3相比,_____熔点高,其主要原因是_______。
(6)铁单质晶体在不同温度下有两种主要的堆积方式——体心立方(A)与面心立方(B),假定Fe原子半径不变,在两种堆积中,配位数之比NA︰NB为_______晶体密度之比ρA︰ρB为_______。
【答案】第四周期第VIII族 3d6 N>C>K 1:1 sp2、sp3 Fe2O3 FeO与Fe2O3都是离子晶体,Fe3+的半径小且电荷大,Fe3+与O2—的离子键键能大(或晶格能大) 2:3 ![]()
【解析】
(1)Fe的核外电子数为26,依据元素周期表结构找出位置;
(2)依据Fe原子核外价层电子排布式书写;
(3)同一周期中,元素的第一电离能呈增大趋势,第VA族元素最高能级为半充满结构,其第一电离能比第VIA族的高;同主族,第一电离能从上到下依次减小;找出内界的共价键类型判断解答;
(4)依据杂化轨道理论分析作答;
(5)依据离子晶体的熔沸点判断依据作答;
(6)根据金属晶体原子堆积模型理论解答。
(1)Fe的原子序数为26,其核外电子数为26,位于元素周期表第四周期第VIII族,
故答案为:第四周期第VIII族;
(2)Fe原子的核外价层电子排布式为3d64s2,[Fe(NO)(CN)5]2-中Fe为+2价,为Fe原子失去2个电子以后所得,则其基态离子的外围电子排布式为3d6,故答案为:3d6;
(3)C与N处于同周期,N原子核外2p能级处于半充满状态,较稳定,第一电离能:N>C,K处于第三周期,第一电离能最小,所以第一电离能比较:N>C>K;K4[Fe(CN)6]内界为Fe(CN)64-,配体CN-电子式为![]() ,与Fe2+之间形成6个配位键,所以σ键数目为6+1×6=12,,π键的数目为2×6=12,则个数比为12:12=1:1,故答案为:N>C>K;1:1;
,与Fe2+之间形成6个配位键,所以σ键数目为6+1×6=12,,π键的数目为2×6=12,则个数比为12:12=1:1,故答案为:N>C>K;1:1;
(4)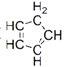 中,全部形成单键的C原子采用sp3杂化方式;同时存在的碳碳双键,则C原子又采用sp2杂化方式,故答案为:sp2、sp3;
中,全部形成单键的C原子采用sp3杂化方式;同时存在的碳碳双键,则C原子又采用sp2杂化方式,故答案为:sp2、sp3;
(5)FeO与Fe2O3均为离子晶体,但Fe3+的半径小且电荷大,Fe3+与O2—的离子键键能大(或晶格能大),所有两者相比,Fe2O3熔点高,故答案为:Fe2O3;Fe3+的半径小且电荷大,Fe3+与O2—的离子键键能大(或晶格能大);
(6)体心立方(A)堆积模型中的配位数为8,面心立方(B)堆积模型中的配位数为12,所有两种堆积模型的配位数之比为:8:12=2:3;设铁原子半径均为r,则根据几何关系可知,体心立方(A)的棱长a(A)=![]() r,晶胞中所含铁原子个数为
r,晶胞中所含铁原子个数为![]() +1=2,则晶体的密度ρA=
+1=2,则晶体的密度ρA=![]() ;同理可知,面心立方(B)堆积模型中a(B)=
;同理可知,面心立方(B)堆积模型中a(B)=![]() r,晶胞中所含铁原子个数为
r,晶胞中所含铁原子个数为![]() +
+![]() =4,则晶体的密度ρB=
=4,则晶体的密度ρB=![]() ,因此两种晶体的密度比ρA︰ρB=
,因此两种晶体的密度比ρA︰ρB=![]() =
=![]() ,故答案为:2:3;
,故答案为:2:3;![]() 。
。

 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g) H=+11 kJ·mol-1。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g) H=+11 kJ·mol-1。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当改变条件,再次达到平衡时,下列有关叙述不正确的是
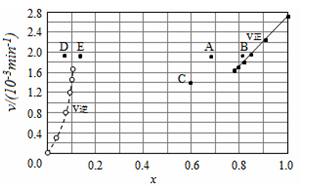
A.若升高温度到某一温度,再次达到平衡时,相应点可能分别是A、E
B.若再次充入a mol HI,则达到平衡时,相应点的横坐标值不变,纵坐标值增大
C.若改变的条件是增大压强,再次达到平衡时,相应点与改变条件前相同
D.若改变的条件是使用催化剂,再次达到平衡时,相应点与改变条件前不同