��Ŀ����
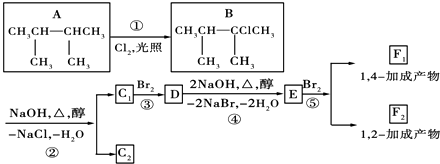
����Ŀ����֪AΪ�������ʣ���ͼ��ʾ�����еĸ�����Ӧ�����������E�ǰ�ɫ������
��1��д���������ʵĻ�ѧʽ��
A��________��B��________��C��________��D��________��E��________��
��2��д�����б仯�Ļ�ѧ����ʽ��
��A��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��_____________________________��
��A����������NaOH��Һ��Ӧ�����ӷ���ʽ��__________________________��
����C����E���̵Ļ�ѧ����ʽ��_____________________________��
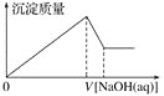
��3����һ������A���뵽NaOH��Һ�У������������ڱ�״���µ����Ϊ3.36 L�������ĵ�A�����ʵ���Ϊ________��ת�Ƶ��ӵ����ʵ���Ϊ________��
���𰸡� Al AlCl3�� NaAlO2�� Al2(SO4)3 Al(OH)3 2Al��2NaOH��2H2O===2NaAlO2��3H2�� Al2O3��2OH��===2AlO2����H2O NaAlO2��CO2��2H2O===NaHCO3��Al(OH)3�� 0.1 mol 0.3 mol
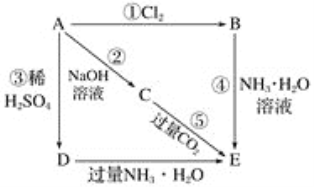
����������֪AΪ�������ʣ���������������Һ��ϡ�������Ӧ����A����������B���Ȼ�����C��ƫ�����ƣ�D����������E������������
��1���������Ϸ�����֪A��E�Ļ�ѧʽ�ֱ���Al��AlCl3��NaAlO2��Al2(SO4)3��Al(OH)3����2��������NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ2Al��2NaOH��2H2O===2NaAlO2��3H2������A����������������NaOH��Һ��Ӧ�����ӷ���ʽΪAl2O3��2OH��===2AlO2����H2O������C����E������CO2��������˷�Ӧ�Ļ�ѧ����ʽΪNaAlO2��CO2��2H2O===NaHCO3��Al(OH)3������3����һ�����������뵽NaOH��Һ�У��������������ʵ�����3.36L��22.4L/mol��0.15mol������ݷ���ʽ��֪��������0.1mol��ת�Ƶ��ӵ����ʵ���Ϊ0.1mol��3��0.3mol��