��Ŀ����
����Ŀ��ijС����COCl26H2O��NH4Cl��H2O2 �� Ũ��ˮΪԭ�ϣ��ڻ���̿���£��ϳɳȻ�ɫ����X��Ϊȷ������ɣ���������ʵ�飮
��1�����ⶨ����ƷX���ܣ������ȵ����ʵ���֮��Ϊ1��6��3���ܵĻ��ϼ�Ϊ��֪X�Ļ�ѧʽ���������л�ѧʽ����������������Ag��NH3��2 OH �����İ���ͭ[Cu��NH3��4]SO4 �� �Ʊ�X�Ļ�ѧ����ʽ
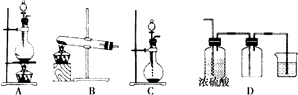
��2�����IJⶨ����ȷ��ȡwgX��������ˮ�ܽ⣬ע����ͼ��ʾ������ƿ�У�Ȼ����μ�������10%NaOH��Һ��ͨ��ˮ����������ƷҺ�еİ�ȫ����������V1mL c1molL��1���������Һ���գ�����������ȡ�½���ƿ����c2molL��1NaOH����Һ�ζ���ʣ��HCl�����յ�ʱ����V2mL NaOH��Һ�� 
�ٷŢݣ������Һ������������
��װ���а�ȫ�ܵ�����ԭ��
����Ʒ�е���������������ʽ ��
���𰸡�
��1��+3��2CoCl2+2NH4Cl+10NH3+H2O2 ![]() 2[Co��NH3��6]Cl3+2H2O
2[Co��NH3��6]Cl3+2H2O
��2����ʽ�ζ��ܣ�ʹAƿ��ѹǿ�ȶ���![]() ��100%
��100%
���������⣺��1�����ⶨ����ƷX���ܡ������ȵ����ʵ���֮��Ϊ1��6��3�����仯ѧʽΪ[Co��NH3��6]Cl3 �� ���ݻ������и�Ԫ�ػ��ϼ۵Ĵ�����Ϊ0��CoԪ�ػ��ϼ�Ϊ+3�ۣ��÷�Ӧ��Coʧ���ӡ�˫��ˮ�õ��ӣ�CoCl26H2O��NH4Cl��H2O2��NH3������Ӧ����[Co��NH3��6]Cl3��ˮ����Ӧ����ʽΪ2CoCl2+2NH4Cl+10NH3+H2O2 ![]() 2[Co��NH3��6]Cl3+2H2O�����Դ��ǣ�+3��2CoCl2+2NH4Cl+10NH3+H2O2
2[Co��NH3��6]Cl3+2H2O�����Դ��ǣ�+3��2CoCl2+2NH4Cl+10NH3+H2O2 ![]() 2[Co��NH3��6]Cl3+2H2O����2���ټ�ֻ��ʢ���ڼ�ʽ�ζ����У�������Һֻ��ʢ������ʽ�ζ����У�����ʢ����Һ���������Ϊ��ʽ�ζ��ܣ����Դ��ǣ���ʽ�ζ��ܣ� ����������ƿ��ѹǿ������С�����������Σ�գ�������A�ڵ�����Һ�����ߣ�������ѹ��������С��������ͨ�����ܽ�����ƿ��Ҳ������ɵ�������ȫ���õ�ԭ����ʹA��ѹǿ�ȶ������Դ��ǣ�ʹAƿ��ѹǿ�ȶ������백����Ӧ��n��HCl��=V1��10��3L��C1molL��1��C2molL��1 ��V2��10��3L=��C1V1��C2V2����10��3mol�����ݰ�����HCl�Ĺ�ϵʽ֪��n��NH3��=n��HCl��=��C1V1��C2V2����10��3mol��������������=
2[Co��NH3��6]Cl3+2H2O����2���ټ�ֻ��ʢ���ڼ�ʽ�ζ����У�������Һֻ��ʢ������ʽ�ζ����У�����ʢ����Һ���������Ϊ��ʽ�ζ��ܣ����Դ��ǣ���ʽ�ζ��ܣ� ����������ƿ��ѹǿ������С�����������Σ�գ�������A�ڵ�����Һ�����ߣ�������ѹ��������С��������ͨ�����ܽ�����ƿ��Ҳ������ɵ�������ȫ���õ�ԭ����ʹA��ѹǿ�ȶ������Դ��ǣ�ʹAƿ��ѹǿ�ȶ������백����Ӧ��n��HCl��=V1��10��3L��C1molL��1��C2molL��1 ��V2��10��3L=��C1V1��C2V2����10��3mol�����ݰ�����HCl�Ĺ�ϵʽ֪��n��NH3��=n��HCl��=��C1V1��C2V2����10��3mol��������������= ![]() ��100%�����Դ��ǣ�
��100%�����Դ��ǣ� ![]() ��100%��
��100%��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�