题目内容
【题目】高纯度氧化铝有广泛的用途,某研究小组研究用以下流程制取高纯度氧化铝:
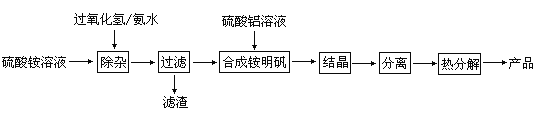
根据上述流程图填空:
(1)“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式____________________________。
(2)通常条件下Ksp〔Fe(OH)3〕=4.0×10—38,除杂后溶液中c(Fe3+)约为_____________。
(3)配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是________________________。
(4)“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干的原因是____________。
(5)“分离”操作的名称是_____________(填字母代号)。
A.蒸馏 B.分液 C.过滤
(6)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,在0.1mol/L铵明矾的水溶液中,离子浓度最大的离子是__________,离子浓度最小的离子是____________。
【答案】2Fe2++H2O2+4NH3·H2O=2Fe(OH)3↓+4NH4+ 4×10—20mol/L 抑制(防止)Al3+水解 防止晶体失去结晶水,避免可溶性杂质结晶析出 C SO42- OH-
【解析】
(1)H2O2可以把Fe2+氧化为Fe3+,然后加入氨水,就会形成Fe(OH)3沉淀而过滤除去,反应的离子方程式是2Fe2++H2O2+4NH3·H2O=2Fe(OH)3↓+4NH4+;
(2)pH=8.0,则c(OH—)=10-6mol/L,在通常条件下Ksp〔Fe(OH)3〕=c(Fe3+)·c3(OH—)=4.0×10—38,所以c(Fe3+)= Ksp〔Fe(OH)3〕÷c3(OH—)= 4.0×10—38÷10-18=4×10—20mol/L;
(3)硫酸铝是强酸弱碱盐,水解产生氢氧化铝胶体和硫酸,加入硫酸就可以抑制盐电离产生的Al3+的水解;
(4)“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干是因为蒸干容易使晶体失去结晶水,这样还避免可溶性杂质结晶析出;
(5)把晶体从混合物中“分离”操作的名称是过滤;
(6)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,在0.1mol/L在铵明矾的水溶液中,根据物料守恒可知离子浓度最大的离子是SO42—,由于该盐是强酸弱碱盐,NH4+、Al3+水解消耗水电离产生的OH-,使溶液显酸性,所以离子浓度最小的离子是OH—。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】 已知常温下部分弱电解质的电离平衡常数如下表:
化学式 | HF | HClO | H2CO3 | NH3·H2O |
电离常数 | 6.8×104 | 4.7×108 | K1=4.3×107 K2=5.6×1011 | Kb=1.7×105 |
(1)常温下,PH相同的三种溶液①NaF溶液 ②NaClO溶液 ③Na2CO3溶液,其物质的量溶度由大到小的顺序是___________(填序号)
(2)25°C时,PH=4的NH4Cl溶液中各离子浓度的大小关系为___________________
(3)0.1 mol/L的NaClO溶液和0.1 mol/L的NaHCO3溶液中,c(ClO-)________ c(HCO3-)(填“>,<,=”)可使上述两种溶液PH相等的方法是___________(填代号)
a.向NaClO溶液中加适量的水 b.向NaClO溶液中加适量的NaOH
c.向NaHCO3溶液中加适量的水 d. 向NaHCO3溶液中加适量的NaOH
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为_________
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性____________(填“酸性”“碱性”“中性”)