题目内容
欲配制500mL、0.1mol/L的碳酸钠溶液,回答下列问题:
(1)通过计算可知,应用托盘天平称取______gNa2CO3?10H2O;
(2)若砝码和药品位置放颠倒(假设称量时未用烧杯,5g内使用游码),天平平衡时,实际称得的碳酸钠晶体的质量是______g;
(3)下列操作使所配溶液浓度偏高的是______.
①称取14.3gNa2CO3进行配制
②称量用了生锈的砝码
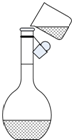
③往容量瓶转移时,有少量液体溅出
④碳酸钠中含有不溶性杂质
⑤未洗涤溶解Na2CO3的烧杯
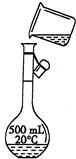
⑥定容时俯视刻度线
⑦小烧杯洗净后未干燥即用来称量.
(1)通过计算可知,应用托盘天平称取______gNa2CO3?10H2O;
(2)若砝码和药品位置放颠倒(假设称量时未用烧杯,5g内使用游码),天平平衡时,实际称得的碳酸钠晶体的质量是______g;
(3)下列操作使所配溶液浓度偏高的是______.
①称取14.3gNa2CO3进行配制
②称量用了生锈的砝码
③往容量瓶转移时,有少量液体溅出
④碳酸钠中含有不溶性杂质
⑤未洗涤溶解Na2CO3的烧杯
⑥定容时俯视刻度线
⑦小烧杯洗净后未干燥即用来称量.
(1)500mL、0.1mol/L的碳酸钠溶液中含有的碳酸钠的物质的量为:0.1mol/L×0.5L=0.05mol,需要Na2CO3?10H2O质量为:286g/mol×0.05mol=14.3g,
故答案为:14.3;
(2)天平称量碳酸钠晶体时质量关系为:m(砝码)+m(游码)=m(药品),称量14.3g碳酸钠晶体,需要砝码10g,游码4.3g,若砝码与碳酸钠颠倒,质量关系为:m(Na2CO3?10H2O)+4.3g=10g,称量的Na2CO3?10H2O的质量为:m(Na2CO3?10H2O)=10g-4.3g=5.7g,
故答案为:5.7;
(3)①称取14.3gNa2CO3进行配制,导致溶液中溶质的物质的量偏大,根据c=
可得,配制的溶液浓度偏高,故①正确;
②称量用了生锈的砝码,导致称量的药品质量偏大,配制的溶液中溶质的物质的量偏大,根据c=
可得,配制的溶液浓度偏高,故②正确;
③往容量瓶转移时,有少量液体溅出,导致配制的溶液中溶质的物质的量偏低,根据c=
可得,溶液的浓度偏低,故③错误;
④碳酸钠中含有不溶性杂质,导致溶质的物质的量偏小,根据c=
可得,溶液的浓度偏低,故④错误;
⑤未洗涤溶解Na2CO3的烧杯,导致溶质的物质的量偏小,根据c=
可得,配制的溶液浓度偏低,故⑤错误;
⑥定容时俯视刻度线,导致加入的蒸馏水体积偏小,根据c=
可得,配制的溶液浓度偏高,故⑥正确;
⑦小烧杯洗净后未干燥即用来称量,称量利用的是烧杯的质量差,所以不影响配制结果,故⑦错误;
故选①②⑥.
故答案为:14.3;
(2)天平称量碳酸钠晶体时质量关系为:m(砝码)+m(游码)=m(药品),称量14.3g碳酸钠晶体,需要砝码10g,游码4.3g,若砝码与碳酸钠颠倒,质量关系为:m(Na2CO3?10H2O)+4.3g=10g,称量的Na2CO3?10H2O的质量为:m(Na2CO3?10H2O)=10g-4.3g=5.7g,
故答案为:5.7;
(3)①称取14.3gNa2CO3进行配制,导致溶液中溶质的物质的量偏大,根据c=
| n |
| V |
②称量用了生锈的砝码,导致称量的药品质量偏大,配制的溶液中溶质的物质的量偏大,根据c=
| n |
| V |
③往容量瓶转移时,有少量液体溅出,导致配制的溶液中溶质的物质的量偏低,根据c=
| n |
| V |
④碳酸钠中含有不溶性杂质,导致溶质的物质的量偏小,根据c=
| n |
| V |
⑤未洗涤溶解Na2CO3的烧杯,导致溶质的物质的量偏小,根据c=
| n |
| V |
⑥定容时俯视刻度线,导致加入的蒸馏水体积偏小,根据c=
| n |
| V |
⑦小烧杯洗净后未干燥即用来称量,称量利用的是烧杯的质量差,所以不影响配制结果,故⑦错误;
故选①②⑥.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目