题目内容
【题目】某温度下在三个体积为1.0L的恒容密闭容器中发生反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g),下列说法正确的是( )
CH3OCH3(g)+H2O(g),下列说法正确的是( )
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
A. 该反应的正向为吸热反应
B. 达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C. 容器I中反应达到平衡所需时间比容器Ⅲ中的长
D. 若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
【答案】D
【解析】试题分析:A.容器Ⅰ中平衡时c(CH3OCH3)=c(H2O)=![]() =0.080mol/L,c(CH3OH)=
=0.080mol/L,c(CH3OH)=![]() =0.04mol/L,容器Ⅰ中化学平衡常数K1=
=0.04mol/L,容器Ⅰ中化学平衡常数K1=![]() =4,容器Ⅲ中平衡时c(CH3OCH3)=c(H2O)=
=4,容器Ⅲ中平衡时c(CH3OCH3)=c(H2O)=![]() =0.090mol/L,c(CH3OH)=
=0.090mol/L,c(CH3OH)=![]() =0.02mol/L,化学平衡常数K2=
=0.02mol/L,化学平衡常数K2=![]() =20.25>4,所以降低温度,化学平衡常数增大,反应向正反应方向移动,则正反应是放热反应,故A正确;B.恒容条件下,容器Ⅱ相当于在容器Ⅰ的基础上加压,但由于该反应是反应前后气体体积不变的反应,因此平衡不移动,所以容器Ⅰ中的CH3OH体积分数和容器Ⅱ中的相等,故B错误;C.容器Ⅰ中的温度比容器III的温度高,温度越高反应速率越快,达到平衡所需时间越短,故C错误;D.c(CH3OH)=0.1mol/L、c(CH3OCH3 )=0.15mol/L、c(H2O)=0.10mol/L,浓度商=
=20.25>4,所以降低温度,化学平衡常数增大,反应向正反应方向移动,则正反应是放热反应,故A正确;B.恒容条件下,容器Ⅱ相当于在容器Ⅰ的基础上加压,但由于该反应是反应前后气体体积不变的反应,因此平衡不移动,所以容器Ⅰ中的CH3OH体积分数和容器Ⅱ中的相等,故B错误;C.容器Ⅰ中的温度比容器III的温度高,温度越高反应速率越快,达到平衡所需时间越短,故C错误;D.c(CH3OH)=0.1mol/L、c(CH3OCH3 )=0.15mol/L、c(H2O)=0.10mol/L,浓度商=![]() =1.5<4,平衡向正反应方向移动,故D正确;故选D。
=1.5<4,平衡向正反应方向移动,故D正确;故选D。

【题目】实验室制取氯气除了用浓盐酸和二氧化锰反应外还可利用下列反应:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O,该反应的优点是反应产生氯气速度快、不需加热.图是实验室利用此反应制备氯气并进行一系列相关实验的装置(夹持设备已略). 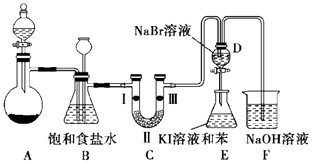
(1)上述反应中是氧化剂,是还原剂,若反应中氧化产物比还原产物多 1mol,则转移的电子数目为 .
(2)装置B的作用是 , 实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象: .
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入(选“a”“b”或“c”)
a | b | c | |
Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E 的目的是为了比较Cl2、Br2、I2的氧化性强弱. 已知Br2 的水溶液因浓度不同而呈现橙色或红棕色,I2难溶于水而易溶苯,且 I2 的苯溶液为紫红色.当向D中缓缓通入足量Cl2时,可以看到无色溶液逐渐变为红棕色,说明 Cl2的氧化性大于 Br2 , 请写出D中对应的离子方程式并用双线桥法表示出电子转移情况: . 打开活塞,将 D中的少量溶液加入E中,振荡E,观察到E中溶液分为两层,上层(苯层)为紫红色.该现象( 填“能”或“不能”)说明Br2的氧化性大于I2 .
(5)装置F的作用是除去污染性的物质(Cl2、Br2 等),已知Cl2与NaOH反应时产物中可能有NaCl、NaClO、NaClO3 , 且 ![]() 值与温度高低有关. 若烧杯中装有500mL0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为L(忽略Cl2溶于水).
值与温度高低有关. 若烧杯中装有500mL0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为L(忽略Cl2溶于水).