题目内容
(Ⅰ)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H
CH3OH(g) △H
已知某些化学键的键能数据如下表:
| 化学键 | C—C | C—H | H—H | C—O | C≡O | H—O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
请回答下列问题:
(1)已知CO中的C与O之间为叁键连接,该反应的△H= ;
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1molCO和2molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
则从反应开始到20min时,以CO表示的平均反应速率= ,该温度下平衡常数K= ,若升高温度则K值 (填“增大”、“减小”或“不变”);
(3)下列描述中能说明上述反应已达平衡的是 ;
A.2v(H2)正=v(CH3OH)逆
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变
D.单位时间内生成nmolCO的同时生成2nmolH2
(Ⅱ)回答下列问题:
(1)体积均为100ml pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则Ka(HX) ______ Ka(CH3COOH)(填>、<或=)
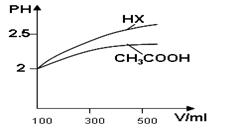
(2)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中C(CH3COO?)-c(Na+)=____________mol·L-1(填精确值)。
Ⅰ(1)-116 KJ/mol (2)0.0125mol/(L·min); 4; 减小。 (3)B C
Ⅱ(1)> (2)9.9×10-7;
解析试题分析:Ⅰ(1)△H=(1072+2×436-3×413-358-463)KJ/mol ="-116" KJ/mol。(2)在恒温、恒压下,P1:P2=n1:n2.12.6:8.4=3:X解得X=2. CO(g)+2H2(g)  CH3OH(g) 在反应开始时n(CO)=" 1mol;" n(H2) =2mol;n(CH3OH)=0mol.假设反应消耗CO的物质的量为a,则20min时n(CO)="(1-a)mol;" n(H2)=" (2-2a)mol;" n(CH3OH)=amol. (1-a)+(2-2a)+a=2.解得a=0.5mol.所以V(CO)=△C/△t=0.5mol÷2L÷20min= 0.0125mol/(L·min) . 该温度下平衡常数K=C(CH3OH)÷{C(CO)·C(H2)}= (0.5÷2)÷{(0.5÷2)×(1÷2)2}=4. 由于该反应的正反应是放热反应。升高温度,化学平衡向吸热反应方向即逆反应方向移动。所以化学平衡常数减小。(3)A.若反应达到平衡,则v(H2)正v(CH3OH)逆=2:1;而A选项的则为v(H2)正v(CH3OH)逆 ="1:2" 。不相等。未达到平衡。B. 该反应是个反应前后气体体积不等的反应,若达到平衡,则气体的物质的量不变。平均摩尔质量也不变。正确。C.该反应是个反应前后气体体积不等的反应,若达到平衡,则气体的物质的量不变。由于容器的容积不变,所以容器中气体的压强保持不变 。正确。D.无论反应是否达到平衡,在任何时刻,每生成nmolCO的必同时生成2nmolH2。错误。故正确选项为B、C。Ⅱ(1)当溶液稀释时溶液的酸性越强,PH变化就越大。故Ka(HX) >Ka(CH3COOH)。(2)由于溶液呈电中性,所以C(Na+)+C(H+)=C(OH-)+C(CH3COO-).25℃时,Kw=10-14,CH3COOH与CH3COONa的混合溶液的pH=6,C(H+)=10-6,则C(OH-)="Kw/" C(H+)=10-14÷10-6=10-8。则溶液中C(CH3COO?)-c(Na+)= C(H+)- C(OH-)=10-6-10-8=9.9×10-7(mol/L).
CH3OH(g) 在反应开始时n(CO)=" 1mol;" n(H2) =2mol;n(CH3OH)=0mol.假设反应消耗CO的物质的量为a,则20min时n(CO)="(1-a)mol;" n(H2)=" (2-2a)mol;" n(CH3OH)=amol. (1-a)+(2-2a)+a=2.解得a=0.5mol.所以V(CO)=△C/△t=0.5mol÷2L÷20min= 0.0125mol/(L·min) . 该温度下平衡常数K=C(CH3OH)÷{C(CO)·C(H2)}= (0.5÷2)÷{(0.5÷2)×(1÷2)2}=4. 由于该反应的正反应是放热反应。升高温度,化学平衡向吸热反应方向即逆反应方向移动。所以化学平衡常数减小。(3)A.若反应达到平衡,则v(H2)正v(CH3OH)逆=2:1;而A选项的则为v(H2)正v(CH3OH)逆 ="1:2" 。不相等。未达到平衡。B. 该反应是个反应前后气体体积不等的反应,若达到平衡,则气体的物质的量不变。平均摩尔质量也不变。正确。C.该反应是个反应前后气体体积不等的反应,若达到平衡,则气体的物质的量不变。由于容器的容积不变,所以容器中气体的压强保持不变 。正确。D.无论反应是否达到平衡,在任何时刻,每生成nmolCO的必同时生成2nmolH2。错误。故正确选项为B、C。Ⅱ(1)当溶液稀释时溶液的酸性越强,PH变化就越大。故Ka(HX) >Ka(CH3COOH)。(2)由于溶液呈电中性,所以C(Na+)+C(H+)=C(OH-)+C(CH3COO-).25℃时,Kw=10-14,CH3COOH与CH3COONa的混合溶液的pH=6,C(H+)=10-6,则C(OH-)="Kw/" C(H+)=10-14÷10-6=10-8。则溶液中C(CH3COO?)-c(Na+)= C(H+)- C(OH-)=10-6-10-8=9.9×10-7(mol/L).
考点:考查反应热、化学反应速率、平衡常数的计算及外界条件对化学平衡的影响、离子浓度比较的知识。

氨是最重要的化工产品之一。
(1)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如下图所示。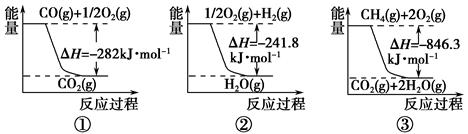
反应①②③为________反应(填“吸热”或“放热”)。
CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为___________。
(2)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。
①某温度下,向容积为10 L的密闭容器中通入2 mol NH3和1 mol CO2,反应达到平衡时CO2的转化率为50%。该反应的化学平衡常数表达式为K=______。该温度下平衡常数K的计算结果为_____。
②为进一步提高CO2的平衡转化率,下列措施中能达到目的的是________。
| A.提高NH3的浓度 | B.增大压强 |
| C.及时转移生成的尿素 | D.使用更高效的催化剂 |
 2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原): 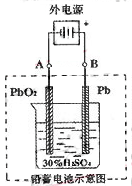
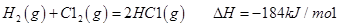
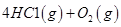
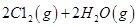

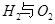 反应生成气态水的热化学方程式__________________________
反应生成气态水的热化学方程式__________________________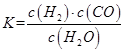
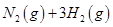
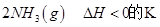 =0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应
=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应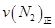 ____________
____________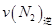 (填:>、<、=、不能确定);
(填:>、<、=、不能确定);
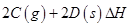 ,其化学平衡常数K与温度T的关系如下表:
,其化学平衡常数K与温度T的关系如下表:
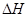 ___________0(填“>”或“<”)
___________0(填“>”或“<”) B.容器内压强保持不变
B.容器内压强保持不变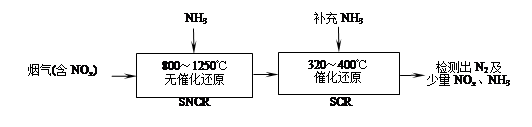
 2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。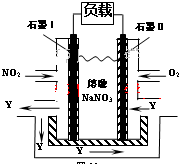
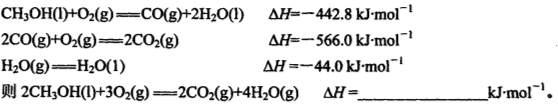
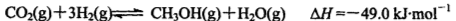
 mol;
mol;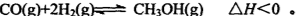

 (填“>”、“<”或“=”)
(填“>”、“<”或“=”) 2SO3(g) ΔH=-196.6 kJ·mol-1反应过程的能量变化示意图。
2SO3(g) ΔH=-196.6 kJ·mol-1反应过程的能量变化示意图。

 起催化作用,使反应按以下两步完成:
起催化作用,使反应按以下两步完成: