题目内容
【题目】煤气中主要的含硫杂质有H2S以及COS(有机硫),煤气燃烧后含硫杂质会转化成SO2从而引起大气污染。煤气中H2S的脱除程度已成为其洁净度的一个重要指标。回答下列问题:
(1)将H2S通入FeCl3溶液中,该反应的还原产物为___________。
(2)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法以及水解法等。
①COS的分子结构与CO2相似,COS的电子式为_____________。
②Br2的KOH溶液将COS氧化为硫酸盐和碳酸盐的离子方程式为_____________。
③已知断裂1mol化学键所需的能量如下:
化学键 | H—H | C═O | C═S | H—S | C≡O |
E/kJmol-1 | 436 | 745 | 577 | 339 | 1072 |
H2还原COS发生的反应为H2(g)+COS(g) ═H2S(g)+CO(g),该反应的ΔH=________kJ·mol-1。
④用活性α—Al2O3催化COS水解的反应为COS(g)+ H2 O(g) ![]() CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与
CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与![]() 的关系如图2所示。
的关系如图2所示。
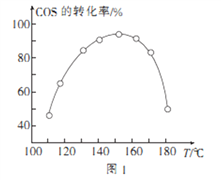

由图1可知,催化剂活性最大时对应的温度约为____________;由图2可知,P点时平衡常数K=_____
(保留2位有效数字)。
(3)常温下可发生反应:ZnS(s)+2H+(aq) ![]() Zn2+(aq)+H2S(aq),达到平衡时,该反应的平衡常数K=_______[已知:Ksp(ZnS)=2.93×10-25;H2S电离常数;Ka1=9.5×10-8,Ka2=1.3×10-14]。
Zn2+(aq)+H2S(aq),达到平衡时,该反应的平衡常数K=_______[已知:Ksp(ZnS)=2.93×10-25;H2S电离常数;Ka1=9.5×10-8,Ka2=1.3×10-14]。
【答案】 Fe2+(或FeCl2) ![]() COS+4Br2+12OH-═CO32-+SO42-+8Br-+6H2O +8 150℃ 0.048 2.4×10-4(或2.37×10-4)
COS+4Br2+12OH-═CO32-+SO42-+8Br-+6H2O +8 150℃ 0.048 2.4×10-4(或2.37×10-4)
【解析】(1)将H2S通入FeCl3溶液中,反应为:H2S+2Fe3+=S↓+2Fe2++2H+,Fe3+被还原为Fe2+,故还原产物为Fe2+(或FeCl2)。
(2)①COS的分子结构与CO2相似,故COS的电子式为![]() ;②碱性溶液,OH-参与反应,生成水,Br2作氧化剂被还原为Br-,故Br2的KOH溶液将COS氧化为硫酸盐和碳酸盐的离子方程式为:COS+4Br2+12OH-=CO32-+SO42-+8Br-+6H2O;③ΔH=(436+745+577-2×339-1072)kJ·mol-1=+8kJ·mol-1;④由图1可得,相同投料比、相同流量且在催化剂表面停留相同时间时,150℃时COS转化率最大,所以该温度下反应速率最快,催化剂活性最大;由图2,可列三段式:
;②碱性溶液,OH-参与反应,生成水,Br2作氧化剂被还原为Br-,故Br2的KOH溶液将COS氧化为硫酸盐和碳酸盐的离子方程式为:COS+4Br2+12OH-=CO32-+SO42-+8Br-+6H2O;③ΔH=(436+745+577-2×339-1072)kJ·mol-1=+8kJ·mol-1;④由图1可得,相同投料比、相同流量且在催化剂表面停留相同时间时,150℃时COS转化率最大,所以该温度下反应速率最快,催化剂活性最大;由图2,可列三段式:
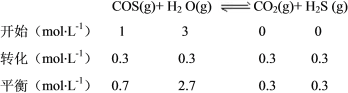
K=![]() =
=![]() =
=![]() ≈0.048。
≈0.048。
(3)K= 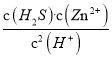 =
= ![]() ÷
÷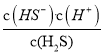 ÷
÷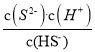 =
= ![]() =
= ![]() ≈ 2.37×10-4 。
≈ 2.37×10-4 。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案