题目内容
实验室用浓盐酸和二氧化锰反应制取氯气时,收集到7.1g氯气,求:
(1)发生反应的二氧化锰的物质的量是多少?
(2)被氧化的氯化氢的物质的量是多少?
(3)有多少个电子发生转移?
解析:
解:(1) MnO2+4HCl(浓)=====MnCl2+Cl2↑+2H2O
(2)被氧化的HCl的物质的量等于被氧化的Cl-的物质的量。
(3)每生成1molCl2,电子转移的数目为2×6.02×1023个。 Cl2 ~ 2e- 71g 2×6.02×1023个 7.1g N N=
|
提示:
MnO2与浓HCl溶液反应的化学方程式为:MnO2+4HCl(浓)
该反应既是氧化还原反应,又是离子反应,离子方程式及电子转移情况为:
由此可知:参加离子反应的Cl-代表了被氧化的HCl,化学反应中生成的Cl2的质量与被氧化HCl的物质的量、电子转移数目、反应MnO2的质量之间存在正比例关系。故本题的题型属于物质的量应用于化学方程式计算,可以采用解物质的量应用于化学方程式计算题的一般方法、步骤求解。
|

①二氧化锰;②碱石灰;③大理石;④氯化钠;⑤双氧水;⑥浓氨水;⑦浓盐酸;⑧蒸馏水。
请根据如图所示的实验装置结合实验原理回答下列问题。

(1)请在下表中填入利用该装置可以制取的气体和所需药品的编号(表格可以不填全)。
可以制取的气体(填化学式) | 所需药品的编号 |
|
|
|
|
|
|
|
|
(2)请简述检查该装置气密性的正确实验操作。
(3)资料显示:“氨气可在纯氧中安静燃烧……”某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去),进行氨气与氧气在不同条件下反应的实验。

①将产生的氨气与过量的氧气通到装置A(催化剂为铂石棉)中,用酒精喷灯加热。请写出氨催化氧化的化学方程式是______________________________________;
②将过量的氧气与氨气分别从B装置中a、b两管进气口通入到装置B中,并在b管上端点燃氨气。则两气体通入的先后顺序是___________________________________________,理由是________________________________________________________。


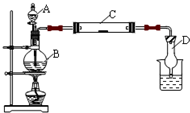 (2011?松江区模拟)为了制得氯气并探究氯气的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中.试回答:
(2011?松江区模拟)为了制得氯气并探究氯气的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中.试回答: 在酸性条件下有很强的氧化性,它在常温下就能将
在酸性条件下有很强的氧化性,它在常温下就能将 氧化为
氧化为 ,
, 被还原成
被还原成 ,写出高锰酸钾跟浓盐酸在室温下反应制取氯气的化学方程式______________________________.
,写出高锰酸钾跟浓盐酸在室温下反应制取氯气的化学方程式______________________________.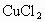 作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气.反应的化学方程式是_______
作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气.反应的化学方程式是_______