题目内容
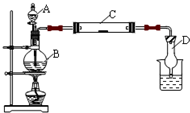 (2011?松江区模拟)为了制得氯气并探究氯气的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中.试回答:
(2011?松江区模拟)为了制得氯气并探究氯气的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中.试回答:(1)怎样检验装置的气密性
关闭分液漏斗,对烧瓶进行微热,看烧杯中是否有气泡产生,冷却后D中是否产生水柱
关闭分液漏斗,对烧瓶进行微热,看烧杯中是否有气泡产生,冷却后D中是否产生水柱
;(2)若C中为淀粉KI试纸,实验片刻后C中可以观察到的实验现象为
试纸变蓝色
试纸变蓝色
;写出B中发生反应的离子方程式
MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O
| ||
MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O
.
| ||
(3)若C中的淀粉KI试纸实验一段时间后又变为无色,原因是
将KI氧化成KIO3
将KI氧化成KIO3
.(4)D的作用是
防倒吸
防倒吸
.烧杯中加入的是氢氧化钠溶液
氢氧化钠溶液
.(5)若实验室暂时无二氧化锰,仍用此装置制取氯气,选用
KMnO4、KClO3
KMnO4、KClO3
药品替代.若实验室暂时无浓盐酸,仍用此装置制取氯气,选用NaCl和浓硫酸
NaCl和浓硫酸
药品替代.分析:(1)根据大气压强原理来检查装置的气密性;
(2)氯气能置换碘单质,碘单质遇淀粉变蓝色,实验室用浓盐酸和二氧化锰加热获得氯气;
(3)碘离子具有较强的还原性,很易被氧化;
(4)氯气可应用氢氧化钠来进行尾气处理,球形导管可以防止倒吸;
(5)可以利用高锰酸钾氧化氯酸钾来获得氯气,浓硫酸和氯化钠反应可以获得氯化氢气体,进而获得盐酸.
(2)氯气能置换碘单质,碘单质遇淀粉变蓝色,实验室用浓盐酸和二氧化锰加热获得氯气;
(3)碘离子具有较强的还原性,很易被氧化;
(4)氯气可应用氢氧化钠来进行尾气处理,球形导管可以防止倒吸;
(5)可以利用高锰酸钾氧化氯酸钾来获得氯气,浓硫酸和氯化钠反应可以获得氯化氢气体,进而获得盐酸.
解答:解:(1)检查装置的气密性的方法是:关闭分液漏斗,对烧瓶进行微热,看烧杯中是否有气泡产生,冷却后D中是否产生水柱,
故答案为:关闭分液漏斗,对烧瓶进行微热,看烧杯中是否有气泡产生,冷却后D中是否产生水柱;
(2)氯气将碘离子氧化为碘单质,碘单质遇淀粉变蓝色,所以会看到试纸变蓝色,实验室制氯气的原理方程式是:MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O,
故答案为:试纸变蓝色;MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O;
(3)淀粉KI试纸中的碘化钾易被氧化为KIO3而又变为无色,故答案为:将KI氧化成KIO3;
(4)氯气可应用氢氧化钠来进行尾气处理,球形导管可以防止倒吸,故答案为:防倒吸;氢氧化钠溶液;
(5)可以用锰酸钾氧化氯酸钾来获得氯气,浓硫酸和氯化钠反应可以获得氯化氢、进而获得盐酸,来代替浓盐酸即可,故答案为:KMnO4、KClO3;NaCl和浓硫酸.
故答案为:关闭分液漏斗,对烧瓶进行微热,看烧杯中是否有气泡产生,冷却后D中是否产生水柱;
(2)氯气将碘离子氧化为碘单质,碘单质遇淀粉变蓝色,所以会看到试纸变蓝色,实验室制氯气的原理方程式是:MnO2+2Cl-+4H+
| ||
故答案为:试纸变蓝色;MnO2+2Cl-+4H+
| ||
(3)淀粉KI试纸中的碘化钾易被氧化为KIO3而又变为无色,故答案为:将KI氧化成KIO3;
(4)氯气可应用氢氧化钠来进行尾气处理,球形导管可以防止倒吸,故答案为:防倒吸;氢氧化钠溶液;
(5)可以用锰酸钾氧化氯酸钾来获得氯气,浓硫酸和氯化钠反应可以获得氯化氢、进而获得盐酸,来代替浓盐酸即可,故答案为:KMnO4、KClO3;NaCl和浓硫酸.
点评:本题考查学生氯气的实验室制法,以及实验装置的气密性检查和药品的处理问题,可以根据所学知识进行回答,难度较大.

练习册系列答案
相关题目

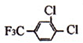 +
+
 +HCl
+HCl A发生缩聚反应
A发生缩聚反应 +nH2O
+nH2O 的含有三氟甲基(F3C一)和苯环的同分异构体共有
的含有三氟甲基(F3C一)和苯环的同分异构体共有