��Ŀ����
����Ŀ�����������о���Ա������ú��������Ȼ�ѧѭ��ʵ��̫���ܵ�ת����洢���������£�
��1����Ӧ��2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ��H1=+551 kJ��mol��1
��Ӧ��S(s)+O2(g)=SO2(g) ��H3=��297 kJ��mol��1
��Ӧ�����Ȼ�ѧ����ʽ��________________________________��
��2��I��������Ϊˮ��Һ��SO2�绯��Ӧ�Ĵ��������ܵĴ��������¡���ii����������
i��SO2+4I��+4H+=S��+2I2+2H2O
ii��I2+2H2O+_________=_________+_______+2 I��_____________
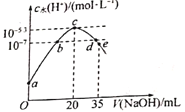
��3��̽��i��ii��Ӧ������SO2�绯��Ӧ���ʵĹ�ϵ��ʵ�����£��ֱ�18 mL SO2������Һ���뵽2 mL�����Լ��У��ܱշ��ù۲�������֪��I2���ܽ���KI��Һ�У�
��� | A | B | C | D |
�Լ���� | 0.4 mol��L��1 KI | a mol��L��1 KI 0.2 mol��L��1 H2SO4 | 0.2 mol��L��1 H2SO4 | 0.2 mol��L��1 KI 0.0002 mol I2 |
ʵ������ | ��Һ��ƣ�һ��ʱ�����ֻ��� | ��Һ��ƣ����ֻ��ǽ�A�� | ���������� | ��Һ���غ�ɫ�ܿ���ɫ����ɻ�ɫ�����ֻ��ǽ�A�� |
��B��A�ĶԱ�ʵ�飬��a=__________��
�ڱȽ�A��B��C���ɵó��Ľ�����______________________��
��ʵ�������SO2���绯��Ӧ����D��A�����i��ii��Ӧ���ʽ���ԭ��________________��
���𰸡�3SO2(g)+2H2O (g)=2H2SO4(l)+S(s)��H2=254kJ��mol1 SO2��SO42��4H+ 0.4 I��SO2�绯��Ӧ�Ĵ�����H+��������ʱ�����д����ã���H+���Լӿ��绯��Ӧ���� ��Ӧii��i�죬D���ɷ�Ӧii������H+ʹ��Ӧi�ӿ�
��������
��1�����ݸ�˹��������Ӧ��=��Ӧ��-��Ӧ��H=-551kJ��mol��1+297kJ��mol��1=-254 kJ��mol-1����ˣ���Ӧ�����Ȼ�ѧ����ʽΪ��3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) ��H2=254kJ��mol1���������������������3SO2(g)+2H2O (g)=2H2SO4(l)+S(s)��H2=254kJ��mol1 ��
��2��SO2��ˮ��Һ�����绯��ӦΪ��3SO2+2H2O=4H++2SO42-+ S�������Է�Ӧii=���ܷ�Ӧ-��Ӧi����1/2��I2+2H2O+ SO2= SO42+4H++2 I��������������������ǣ�SO2��SO42��4H+��
��3����B��A�ĶԱ�ʵ�飬���ÿ��Ʊ�������B��A�����0.2 mol��L��1H2SO4��B��A�� KIŨ��Ӧ��ȣ���a=0.4���������������������0.4��
�ڶԱ�A��B������H+���Լӿ�SO2�绯��Ӧ�����ʣ��Ա�B��C������H+���ܴ�SO2���绯��Ӧ���Ƚ�A��B��C���ɵó��Ľ����ǣ� I��SO2�绯��Ӧ�Ĵ����� H+��������ʱ�����д����ã��� H+���Լӿ��绯��Ӧ���ʣ�����������������ǣ�I��SO2�绯��Ӧ�Ĵ�����H+��������ʱ�����д����ã���H+���Լӿ��绯��Ӧ���ʡ�
���Ա�D��A,D�м���⻯�ص�Ũ��С��A��D�ж���˵ⵥ�ʣ���Ӧ������H+��I����Ӧ��������I2��D�С���Һ���غ�ɫ�ܿ���ɫ����ɻ�ɫ�����ֻ��ǽ�A�족����Ӧ����D��A���ɴ˿ɼ�����Ӧ���ȷ�Ӧ�����ʿ죬��Ӧ������H+ʹc��H+�����Ӷ���Ӧ���ӿ죻����������������ǣ���Ӧii��i�죬D���ɷ�Ӧii������H+ʹ��Ӧi�ӿ���

 ��һ����ͬ���ɽ�����ϵ�д�
��һ����ͬ���ɽ�����ϵ�д� ������Ӧ���ϵ�д�
������Ӧ���ϵ�д�����Ŀ��ӡˢͭ�Ƶ�·��ĸ�ʴҺѡȡ�ͻ���������һֱ���о����ȵ㡣
��1��FeCl3��Һһֱ��Ϊ��ͳ�ĸ�ʴҺ��
�� ��ʴ�����е����ӷ���ʽΪ______��
![]()
�� ��ʴ������ͨ�����������ɷ����ͭ����ʵ��FeCl3��Һ������
i. ����I�����Լ��Ͳ����ֱ�Ϊ______��
ii. ��ʵ�ֲ���IIת�������ʻ���______����һ�ּ��ɣ���
��2���о����֣�CuCl2��Һ���������ˮ���Ƴ����Ը�ʴҺ����Ը�ʴҺ����Ч������FeCl3��Һ����ʴҺ����Ҫ�ɷּ���ʴԭ��������
��ʴҺ���� | ��Ҫ�ɷ� | ��ʴԭ�� |
���Ը�ʴҺ | Cu2+��H+��Cl- | Cu+ Cu2++2Cl�� CuCl+2Cl�� |
���Ը�ʴҺ | Cu(NH3)42+��NH4+��NH3��Cl- | Cu(NH3)42++ Cu === 2Cu(NH3)2+ |

�����Ը�ʴҺ��ͭ���Ӻ����Ը�ʴ���ʵ�Ӱ������ͼ��ʾ��Ϊ���ֽϿ�ͽ�ƽ�ȵĸ�ʴ���ʣ���ʴҺ��ͭ���Ӻ���Ӧѡ��______ g/100mL��ʹ�÷�Χ��
�����Ը�ʴ��Һ������������һ������ˮ�У��ɵ�CuCl���������ˡ�ϴ�ӡ�����ò�ƷCuCl������һ������ˮ�У��ɵ�CuCl������ԭ����_______��
�� ͨ��������������ʹ���Ը�ʴҺ���������ù��̵����ӷ���ʽ����������______________
![]()
��3��H2O2Ҳ��������ʴ����ͭ��ʹ��ʱ���������ˮ�������Ƴ����Ի���Ը�ʴҺ���������Һ�Ĺ������£�


�� ����������H2O2��ʴ����ͭ�����ӷ���ʽΪ______��
�� ��ͼ���о����Ը�ʴҺ���¶ȶ�ͭ��ʴ����ʵ�����������¶�����ʴ���仯��ԭ��______��
�� ��תʱ�ķ�ӦΪ��Cu2(OH)3Cl+NaOH =CuO+Cu(OH)2+NaCl+H2O������ת����ȫ�ķ����ǣ�ȡ����ϴ�Ӻ�ļ�ת���壬_______��
����Ŀ������������� ijС������H2C2O4��Һ������KMnO4��Һ��Ӧ��̽������������Ի�ѧ��Ӧ���ʵ�Ӱ������ʵ��ʱ���ȷֱ���ȡ������Һ��Ȼ�����Թ���Ѹ����Ͼ��ȣ���ʼ��ʱ��ͨ���ⶨ��ɫ����ʱ�����жϷ�Ӧ�Ŀ�������С����������·�����
ʵ���� | H2C2O4��Һ | ����KMnO4��Һ | �¶� | ||
Ũ��(mol��L��1) | ���(mL) | Ũ��(mol��L��1) | ��� (mL) | ||
�� | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
�� | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
�� | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
��1��Ϊ�˹۲쵽��ɫ��ȥ��H2C2O4��KMnO4��ʼ�����ʵ�����Ҫ����Ĺ�ϵΪn(H2C2O4)��n(KMnO4)�� ______��
��2��̽���¶ȶԻ�ѧ��Ӧ����Ӱ���ʵ������________(���ţ���ͬ)����̽����Ӧ��Ũ�ȶԻ�ѧ��Ӧ����Ӱ���ʵ������________��
��3��ʵ��ٲ��KMnO4��Һ����ɫʱ��Ϊ40s�����Ի��ǰ����Һ�����С�仯�����ʱ����ƽ����Ӧ����v(KMnO4)��________mol��L��1��min��1��
��4����֪ʵ�����c(MnO4��)����Ӧʱ��t�ı仯��������ͼ�����������������䣬����ͼ�л���ʵ�����c(MnO4��)��t�ı仯����ʾ��ͼ��_______

����Ŀ���������dz��õķ���������Ҫ��ҽҩԭ�ϡ�һ��ҩ�ñ�������Ʊ��������£�
���ڷ�Ӧ���м���ױ�������KMnO4��Һ��Fe2O3(����)�����ȡ�������Сʱ����ַ�Ӧ��
��Ӧ������Ϊ����װ�á���������ֱ�������ܱڲ��ٳ������顣
����Ӧ���еĻ������ȹ��ˣ�������������ˮϴ�ӡ�
��������Һ�еμ�Ũ�����ữ��pH=2�����ˣ�������ˮϴ�ӣ�����ñ������Ʒ��
�������ֱ���������������ᾧ��ϴ�ӡ����ˣ��õ�ҩ�ô������ᡣ
��֪��������ʵ��ܽ��(g/mL)
�¶ȣ��棩 | 25 | 50 | 60 | |
������ | ��ˮ�� | 0.0034 | 0.0085 | 0.0095 |
���Ҵ��� | 0.4 | 0.7 | 1 | |
�Ȼ��� | ���Ҵ��� | ���� | ||
(1)���з�������Ҫ��ӦΪ��![]() (δ��ƽ)������з�����Ӧ�����ӷ���ʽΪ______��
(δ��ƽ)������з�����Ӧ�����ӷ���ʽΪ______��
(2)���������Ŀ����______��
(3)���г��ȹ��˵�Ŀ����______��
(4)�����������������______��