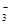题目内容
某兴趣小组在课外活动中对某溶液进行了多次的检测,其中的三次检测结果如下表所示,请回答下列问题:
(1)三次检测结果中,第 次的结果肯定不正确。
(2)在检测时,为了确定溶液中是否存在SO42-、CO32-和Cl-,该小组的学生进行了如下表所示的实验,请仔细分析实验,将表格补充完整:
(3)在上述实验的第一步中,能否将硝酸改为稀盐酸? (填“能”或“不能”,如果填“能”,则不用说理由;如果填“不能”,则说明理由)。
| | 溶液中检测出的溶质 |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、BaCl2、Na2CO3、NaCl |
| 第三次 | KCl、K2CO3、Na2SO4、NaCl |
(1)三次检测结果中,第 次的结果肯定不正确。
(2)在检测时,为了确定溶液中是否存在SO42-、CO32-和Cl-,该小组的学生进行了如下表所示的实验,请仔细分析实验,将表格补充完整:
| 实验步骤 | 实验操作 | 实验目的 | 反应的离子方程式 |
| 第一步 | 向溶液中滴加过量的硝酸 | 检验 ① 的存在 | ② |
| 第二步 | 继续滴加过量的 ③ 溶液 | 检验SO42-的存在 | ④ |
| 第三步 | 过滤,再向滤液中滴加 ⑤ 溶液 | 检验 ⑥ 的存在 | Ag++Cl- = AgCl↓ |
(3)在上述实验的第一步中,能否将硝酸改为稀盐酸? (填“能”或“不能”,如果填“能”,则不用说理由;如果填“不能”,则说明理由)。
(1)二
(2)① CO32- ② 2H+ + CO32- = CO2↑ + H2O
③ Ba(NO3)2溶液 ④ Ba2+ + SO42- = BaSO4↓ ⑤ AgNO3溶液⑥ Cl-
(3)不能 若加入盐酸,则引入Cl-
(2)① CO32- ② 2H+ + CO32- = CO2↑ + H2O
③ Ba(NO3)2溶液 ④ Ba2+ + SO42- = BaSO4↓ ⑤ AgNO3溶液⑥ Cl-
(3)不能 若加入盐酸,则引入Cl-
试题分析:(1)因BaCl2+Na2SO4=BaSO4↓+2NaCl;BaCl2+K2CO3=BaCO3↓+2KCl,所以氯化钡与硫酸钠在同一溶液中不共存,碳酸钾和氯化钡在同一溶液中不共存,三次检测中,第二次检测结果肯定不正确,故(2)用三种试剂将三种离子检验出来,每加一种试剂能够检验出一种离子,此时要注意每加入一种试剂只能与一种离子结合,检验氯离子可以使用银离子,检验硫酸根离子可以使用钡离子,检验碳酸根离子可以使用氢离子,而碳酸根离子和钡离子都可以与钡离子离子结合成沉淀,所以需先检验碳酸根离子,此时可以加入稀硝酸,其次检验硫酸根离子,离子反应方程式为2H+ + CO32- = CO2↑ + H2O,此时加过量的硝酸钡溶液,检验并除去硫酸根离子,离子反应方程式为:Ba2+ + SO42- = BaSO4↓,最后检验氯离子离子,可以加入硝酸银。(3) 不能加入盐酸,若加入盐酸,则引入Cl-。

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
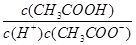 增大
增大 和
和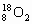 互为同位素,性质相似
互为同位素,性质相似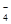
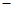 、SO42-、Fe3+、H+、M,其物质的量浓度之比
、SO42-、Fe3+、H+、M,其物质的量浓度之比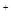 )︰c(M)=5︰3︰2︰3︰2,则M可能是( )
)︰c(M)=5︰3︰2︰3︰2,则M可能是( )