题目内容
【题目】已知热化学方程式:H2O(g)=H2(g)+![]() O2(g) △H= +241.8kJ/mol,H2(g)+
O2(g) △H= +241.8kJ/mol,H2(g)+![]() O2(g)=H2O(1) △H= -285.8kJ/mol
O2(g)=H2O(1) △H= -285.8kJ/mol
当1g水蒸气变为液态水时,其焓变为
A.△H= +4.4kJ/molB.△H= -4.4kJ/mol
C.△H= -2.44kJ/molD.△H= +2.44kJ/mol
【答案】C
【解析】
①H2O(g)=H2(g)+![]() O2(g) △H= +241.8kJ/mol,②H2(g)+
O2(g) △H= +241.8kJ/mol,②H2(g)+![]() O2(g)=H2O(1) △H= -285.8kJ/mol;
O2(g)=H2O(1) △H= -285.8kJ/mol;
①+②,整理可得H2O(g)=H2O(1) △H= -44kJ/mol,根据该热化学方程式可知:18g水蒸气变为液态水时放出44kJ的热量,则1g水蒸气变为液态水时,放出热量是44kJ÷18=2.44kJ,即当1g水蒸气变为液态水时,其焓变△H= -2.44kJ/mol,故合理选项是C。

【题目】50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
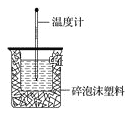
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是_______________,烧杯间填满碎泡沫塑料的作用是_________________。
(2)向盐酸中倒入NaOH溶液的正确操作是:________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)大烧杯上如果不盖硬纸板,则求得的中和热 ________(填“偏大”、“偏小”或“无影响”)。
(4)两次实验记录的数据如下表:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50mL 0.55mol/L NaOH溶液 | 50mL 0.5mol/L HCl溶液 | 20℃ | 23.3℃ | |
② | 50mL 0.55mol/L NaOH溶液 | 50mL 0.5mol/L HCl溶液 | 20℃ | 23.4℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18kJ/(℃·kg),各溶液的密度均为1g/cm3。则中和热ΔH=_________kJ·mol-1。
(5)若改用60mL 0.50mol·L-1 盐酸和50mL 0.55mol·L-1 NaOH溶液进行反应与上述实验相比,所放出的热量_______(填“相等”“不相等”),若实验操作均正确,则所求中和热__________(填“相等”“不相等”)。