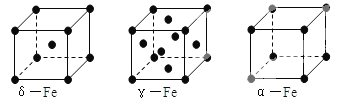
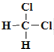题目内容
【题目】下列关于晶体的说法正确的组合是( )
①组成金属的微粒是原子
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻

⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A. ①②③⑥B. ①②④C. ③⑤⑦D. ③⑤⑧
【答案】D
【解析】
①金属单质属于金属晶体,金属晶体由金属阳离子和自由电子构成,故①错误;
②晶体中含有阴离子,则一定含有阳离子,但含有阳离子不一定有阴离子,如金属晶体由阳离子与自由电子构成,没有阴离子,故②错误;
③金刚石、SiC属于原子晶体,键长C-C<Si-C,故金刚石中化学键更稳定,其熔点更高;H2O、H2S都属于分子晶体,水分子之间存在氢键,熔点较高;NaF、NaCl都属于离子晶体,离子半径氟离子小于氯离子,离子键更强,NaF熔点更高;熔点原子晶体>离子晶体>分子晶体,故金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低,故③正确;
④共价化合物一定不含离子键,但离子晶体中可能含有共价键,如氢氧化钠、过氧化钠、铵盐等,故④错误;
⑤以顶点Ti4+离子研究,与之最近的O2-位于面心上,每个Ti4+离子为12个面共用,故每个Ti4+和12个O2-相紧邻,故⑤正确;
⑥SiO2晶体中每个硅原子与4个氧原子形成4个Si-O共价键,故⑥错误;
⑦分子间作用力影响物理性质,分子稳定性属于化学性质,故⑦错误;
⑧氯化钠属于离子晶体,微粒之间作用力为离子键,熔化时破坏离子键,故⑧正确。
正确的有③⑤⑧,故选D。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案【题目】化学在生活中有着广泛的应用,下列对应关系错误的是
选项 | 化学性质 | 实际应用 |
A |
| 泡沫灭火器灭火 |
B |
| 可作面包的发泡剂 |
C | 乙酸具有酸性 | 常用于工业管道去除水垢 |
D | 次氯酸盐具有氧化性 | 漂白粉漂白织物 |
A.AB.B.C.CD.D
【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
请按要求回答下列问题:
(1)①~⑨九种元素中非金属性最强的是________(填元素符号)。
(2)元素⑧的原子结构示意图是_________;由①、④、⑥三种元素组成的化合物,其电子式是_________。
(3)元素②、⑧的气态氢化物的稳定性较强的是________________(填化学式);元素③、⑨的最高价氧化物对应的水化物的酸性较强的是________________(填化学式)。
(4)③、④span>、⑧三种元素的原子半径由大到小的顺序是________________(填元素符号)。
(5)元素⑤、⑥组成的化合物的化学键类型是________________________。
(6)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式是________________