题目内容
将ag镁铝合金投入到x mL 2mol/L的盐酸中,金属完全溶解后,再加入y mL 1mol/L的氢氧化钠溶液,得到的沉淀量最大,质量为 g。下列说法不正确的是
g。下列说法不正确的是
A.镁铝合金与盐酸反应转移电子总数为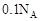 |
B. |
C.沉淀是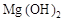 和 和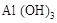 的混合物 的混合物 |
| D.1.2>a>0.9 |
B
解析试题分析:A、沉淀量最大,说明沉淀是Mg(OH)2和Al(OH)3的混合物,所以混合物含有的OH-的质量为1.7g,物质的量=1.7g÷17g/mol=0.1mol。镁铝合金提供的电子等于混合物中OH-所带的电量,所以镁铝合金与盐酸反应转移电子总数为0.1mol×NAmol-1=0.NA,故A正确;B、加入氢氧化钠后,最终溶液为氯化钠溶液,根据氯离子、钠离子守恒可知n(HCl)=n(NaCl)=n(NaOH),所以x mL×2mol/L=y mL×1mol/L,即y=2x,故B错误;C、氢氧化镁、氢氧化铝不溶于水,得到的沉淀量最大,氢氧化铝没有与氢氧化钠反应,沉淀是Mg(OH)2和Al(OH)3的混合物,故C正确;D、由B中分析可知,y=2x,故D正确,答案选B。
考点:考查镁铝性质以及混合物的有关计算

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案下列物质放置在空气中因发生氧化还原反应而变质的是( )
| A.氢氧化钠 | B.氧化钙 | C.过氧化钠 | D.氯化钠 |
下列图像与对应的实验内容不相符的是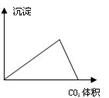
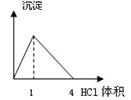
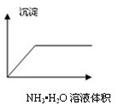
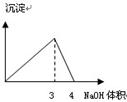
A B C D
| A.在澄清石灰水中通入CO2气体至过量 |
| B.在NaAlO2溶液中逐滴加入HCl溶液至过量 |
| C.在AlCl3溶液中逐滴加入氨水至过量 |
| D.在AlCl3溶液中逐滴加入NaOH溶液至过量 |
在FeCl3和CuSO4溶液中加入过量的铁粉,经过滤后测定反应前后溶液的质量不变(不计过滤损失)。则原来溶液中FeCl3和CuSO4的物质的量之比为
| A.1∶1 | B.2∶1 | C.1∶7 | D.2∶7 |
C和CuO在一定温度下反应,产物有Cu、Cu2O、CO、CO2。将1.20 g C跟16.0 g CuO混合,隔绝空气加热,将生成的气体全部通过足量的澄清石灰水,反应一段时间后共收集到1.12 L气体(标准状况),生成沉淀的质量为5.00 g。下列说法正确的是
| A.反应后的固体混合物中还含有碳 |
| B.反应后的固体混合物总质量为13.6 g |
| C.反应后的固体混合物中氧化物的物质的量为0.05 mol |
| D.反应后的固体混合物中单质Cu的质量为12.8 g |
将等物质的量的镁和铝混合均匀,再将混合物均分为四份,分别加入足量的下列溶液,充分反应后,放出氢气最多的是
| A.8mol/L NaOH溶液 | B.2mol/L HNO3溶液 |
| C.3mol/L HC1溶液 | D.18mol/LH2SO4溶液 |
下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al
| A.③④ | B.②③④ | C.①③④ | D.全部 |
a g钠、铝的混合物投入足量水中,充分反应得到沉淀c g,则溶液中的溶质为
| A.NaAlO2 | B.NaOH | C.NaOH和NaAlO2 | D.无法确定 |
