题目内容
16.(1)标况下,1.92g某气体的体积为672mL,则该气体的摩尔质量为64g/mol;(2)某金属氯化物为MCl29.5g,含有0.200molCl-,则该氯化物的摩尔质量95g/mol,金属M的相对原子质量为24.
(3)71.5g碳酸钠晶体(Na2CO3•10H2O)溶于水,配成500ml溶液,此溶液的物质的量浓度为0.5mol/L.
(4)质量都是10g的HCl、NH3、CO2、H2四种气体在标准状况下,体积最小的是CO2;密度最小的是H2.(填化学式)
分析 (1)根据摩尔质量M=$\frac{m}{n}$=$\frac{m}{\frac{V}{{V}_{m}}}$来计算;
(2)1molMCl2中含2mol氯离子,据此求出MCl2的物质的量,然后根据摩尔质量M=$\frac{m}{n}$来计算;
(3)求出Na2CO3•10H2O的物质的量,然后根据1molNa2CO3•10H2O中含1molNa2CO3,根据物质的量浓度c=$\frac{n}{V}$来计算;
(4)当质量相同时,摩尔质量越大,物质的量越小,则在相同状态下体积越小;密度和摩尔质量成正比.
解答 解:(1)根据摩尔质量M=$\frac{m}{n}$=$\frac{m}{\frac{V}{{V}_{m}}}$=$\frac{1.92g}{\frac{0.672L}{22.4L/mol}}$=64g/mol,故答案为:64g/mol;
(2)1molMCl2中含2mol氯离子,故含有0.200molCl-时,MCl2的物质的量为0.1mol,其摩尔质量M=$\frac{m}{n}$=$\frac{9.5g}{0.1mol}$=95g/mol,金属M的相对原子质量为95-71=24,故答案为:95g/mol,24;
(3)71.5gNa2CO3•10H2O的物质的量n=$\frac{71.5g}{286g/mol}$=0.25mol,而0.25molNa2CO3•10H2O中含0.25molNa2CO3,故溶液的物质的量浓度c=$\frac{n}{V}$=$\frac{0.25mol}{0.5L}$=0.5mol/L,故答案为:0.5mol/L;
(4)当质量相同时,摩尔质量越大,物质的量越小,则在相同状态下体积越小,故体积最小的是CO2;密度和摩尔质量成正比,摩尔质量越大,密度越大,故密度最小的是 H2.故答案为:CO2,H2.
点评 本题考查了摩尔质量、物质的量浓度和相对分子质量的有关计算,难度不大,掌握公式的运用是关键.

 优等生题库系列答案
优等生题库系列答案| A. | 苯在一定条件下能与浓硝酸发生加成反应生成硝基苯 | |
| B. | 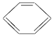 表示苯的分子结构,其中含有碳碳单键和碳碳双键,因此苯的性质跟乙烯的相似 表示苯的分子结构,其中含有碳碳单键和碳碳双键,因此苯的性质跟乙烯的相似 | |
| C. | 苯的分子式为C6H6,分子中氢原子个数比较少,能和溴水反应 | |
| D. | 苯分子的碳环为平面正六边形结构,6个碳原子之间的键完全相同 |
| A. | A2、B2、AB的浓度相等 | |
| B. | 容器中的压强不再随时间变化而变化 | |
| C. | A2、B2、AB的浓度之比为1:1:2 | |
| D. | 单位时间内生成n mol A2的同时生成2n molAB |
| A. | 青霉素对病原体有抑制和杀灭作用,但在使用之前要进行过敏性实验 | |
| B. | 吗啡、海洛因等虽有麻醉、止痛、镇静作用,但易上瘾且有害,这类物质属于毒品 | |
| C. | 青霉素是一种天然抗生素 | |
| D. | R表示非处方药,OTC表示处方药 |
| A. | l种 | B. | 2种 | C. | 3种 | D. | 4种 |
| A. | $\frac{ab}{2V}$mol.L-1 | B. | $\frac{ab}{2000V}$mol.L-1 | C. | $\frac{250ab}{V}$mol.L-1 | D. | $\frac{ab}{80V}$mol.L-1 |
| A | 用图①装置蒸发稀盐酸制浓盐酸 |
| B | 用图②装置分液时,下层液体从分液漏斗下口放出,关闭活塞再将上层液体从上口倒出 |
| C | 用图③洗涤沉淀时,漏斗中加入适量蒸馏水,搅拌并滤干 |
| D | 用图④装置,分离四氯化碳与苯的混合溶液 |

| A. | A | B. | B | C. | C | D. | D |
| A. | 升高温度,固体的量减少 | |
| B. | 加入少量Na2CO3粉末能增大钙离子的浓度 | |
| C. | 恒温下加入少量CaO,溶液的pH增大 | |
| D. | 降低温度,溶液中c(OH-)增大 |