题目内容
将20 mL NO2和NH3的混合气体,在一定条件下充分反应,化学方程式为: 6NO2+8NH3=7N2+12H2O,已知参加反应的NO2比参加反应的NH3少2 mL(气体体积均在相同状况下测定),则原混合气体中NO2和NH3的物质的量之比是( )
①3:2 ②2:3 ③3:7 ④3:4
| A.①③ | B.②④ | C.①② | D.③④ |
A
解析试题分析:根据方程式6NO2+8NH3=7N2+12H2O可知,每消耗6体积的NO2,同时就消耗8体积的氨气,即参加反应的NO2比参加反应的NH3少2体积。因此如果参加反应的NO2比参加反应的NH3少2 mL,则参加反应的NO2和氨气方便是6ml和8ml,剩余20ml-14ml=6ml。若剩余NO2,则原混合气体中NO2和NH3的物质的量之比是12:8=3:2;若剩余氨气,则原混合气体中NO2和NH3的物质的量之比是6:14=3:7,答案选A。
考点:考查氨气和NO2反应的有关计算
点评:该题是中等难度的试题,试题针对性强,属于中等难度的试题。该题的关键是依据反应的方程式,结合数学中的讨论法逐一进行排除、分析、判断即可,有利于培养学生的逻辑推理能力和逆向思维能力。

一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况)向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤、洗涤、灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1。则V可能为
| A.9.0L | B.13.5L | C.15.7L | D.16.8L |
下图所示的是验证二氧化硫性质的微型实验,a、b、c、d是浸有相关溶液的棉球。将硫酸滴入装有亚硫酸钠固体的培养皿。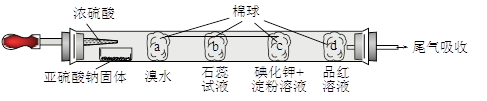
关于此实验的“现象”、“解释或结论”以及对应关系均正确的是
| 选项 | 现象 | 解释或结论 |
| A | a处黄色褪去 | 非金属性:Br>S |
| B | b处变为红色 | 二氧化硫与水反应生成酸性物质 |
| C | c处变为蓝色 | 二氧化硫具有一定的氧化性 |
| D | d处红色先褪去后恢复 | 二氧化硫具有漂白性且漂白性不稳定 |
标准状况下2.24LH2和Cl2组成的混合气体,经光照后缓缓通入100ml 1mol/LNaOH溶液中充分反应,测得最终溶液中NaClO的浓度为0.1mol/L(假设溶液体积不变,且不考虑水解),则原混合气体中Cl2的体积分数为( )
| A.55% | B.60% | C.65% | D.70% |
叠氮酸钠(NaN3)是无色离子晶体,遇高温或剧烈震动能发生强烈爆炸,快速分解成钠单质和氮气,是汽车安全气囊中的成分之一。下列有关说法正确的是
| A.NaN3中只含有离子键 |
| B.1molNaN3完全分解最多可以产生33.6LN2 |
| C.NaN3快速分解时,NaN3既是氧化剂,又是还原剂 |
| D.常温下,NaN3化学性质稳定,包装盒上无需特别说明注意事项 |
某校化学实验小组为了证明铜与稀硝酸反应产生一氧化氮,用如图所示装置进行实验(加热装置和夹持装置均已略去,装置气密性良好,F是用于鼓入空气的双连打气球)。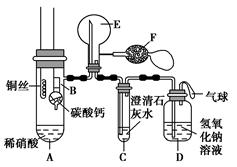
实验操作及现象:
| 实验操作 | 现象 |
| Ⅰ.将B装置下移,使碳酸钙与稀硝酸接触 | 产生气体 |
| Ⅱ.当C装置中产生白色沉淀时,立刻将B装置上提 | |
| Ⅲ.将A装置中铜丝放入稀硝酸中,给A装置微微加热 | A装置中产生无色气体 E装置中开始时出现浅红棕色气体 |
| Ⅳ.用F装置向E装置中鼓入空气 | E装置内气体颜色逐渐加深 |
| Ⅴ.一段时间后 | C装置中白色沉淀溶解 |
试回答下列问题:
(1)操作Ⅰ中产生气体的化学式为 ;操作Ⅰ的目的是 ;D装置的作用是 。
(2)C装置中白色沉淀的化学式是 ,操作Ⅱ中当C装置中产生白色沉淀时立刻将B装置上提的原因是 。
(3)操作Ⅲ中A装置中产生无色气体的化学方程式是 。
(4)E装置内气体颜色逐渐加深的原因是 。
(5)操作Ⅴ现象产生的原因是(用化学方程式说明) 。
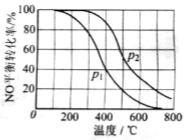
 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如右图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如右图)。