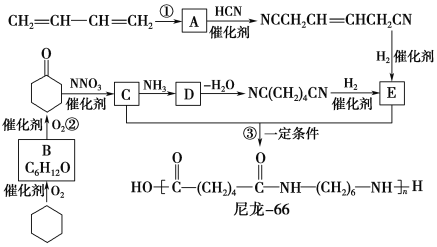
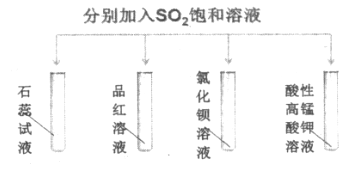
题目内容
【题目】某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。
查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+===Cu+Cu2++H2O
探究一:用如图所示装置进行实验,回答下列问题:
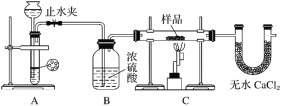
(1)仪器组装完成后,夹好止水夹,___________________________________________,则说明装置A的气密性良好。
(2)装置A是氢气的发生装置,可以选用的药品是________(填选项)。
A.稀硫酸和锌片 B.稀硝酸和铁片 C.氢氧化钠溶液和铝片 D.浓硫酸和镁片
(3)从下列实验步骤中,选择正确的操作顺序:①________③(填序号)。
①打开止水夹
②熄灭C处的酒精喷灯
③C处冷却至室温后,关闭止水夹
④点燃C处的酒精喷灯
⑤收集氢气并验纯
⑥通入气体一段时间,排尽装置内的空气
探究二:
(4)取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,则说明样品中不含Cu2O;此观点是否正确________(填“是”或“否”),若填“否”,则原因是_________________________________(用离子方程式说明);
另取少量样品于试管中,加入适量的浓硝酸,产生红棕色的气体,证明样品中一定含有__________,取少量反应后的溶液,加适量蒸馏水稀释后,滴加_____________________(填试剂和实验现象),则可证明另一成分存在,反之,说明样品中不含该成分。
探究三:
(5)取一定量样品于烧杯中,加入足量的稀硫酸,若反应后经过滤得到固体3.2g,滤液中Fe2+有1.0mol,则样品中n(Cu2O)=________mol。
【答案】)向装置A中的长颈漏斗内加水至形成一段水柱,若一段时间内水柱高度保持不变 AC ⑥⑤④② 否 2Fe3++Cu===2Fe2++Cu2+ Cu2O KSCN溶液,若溶液变红色 0.55
【解析】
(1)仪器组装完成后,夹好止水夹,向装置A中的长颈漏斗内加水至形成一段水柱,若一段时间内水柱高度保持不变,则说明装置A的气密性良好;综上所述,本题答案是:向装置A中的长颈漏斗内加水至形成一段水柱,若一段时间内水柱高度保持不变。
(2) 装置A为固液不加热型,稀硫酸和锌片反应能生成氢气,稀硝酸和铁片反应生成一氧化氮,浓硫酸和镁片反应生成二氧化硫,氢氧化钠溶液和铝片反应生成氢气,AC项正确;综上所述,本题答案是:AC。
(3) 在实验前应先将装置内空气排尽并验纯,实验结束后应先熄灭酒精灯,保持气体继续通入一段时间后关闭止水夹,所以正确的操作顺序是①⑥⑤④②③;综上所述,本题答案是:⑥⑤④②。
(4)样品中含有的氧化铁溶于稀硫酸生成铁离子,Cu2O在酸性条件下发生歧化反应生成亚铜离子和金属铜,铜与铁离子发生反应:2Fe3++Cu===2Fe2++Cu2+,所以看不到无红色物质生成,但不能说明样品中不含Cu2O;另取少量样品于试管中,加入适量的浓硝酸,产生红棕色的气体,即反应生成了二氧化氮,说明样品中含有还原性物质,即含有Cu2O;如果反应后的溶液中含有铁离子,可以用硫氰化钾溶液进行检验,如果出现红色溶液,证明含有铁离子;综上所述,本题答案是:否 ,2Fe3++Cu===2Fe2++Cu2+;Cu2O;KSCN溶液,若溶液变红色。
(5)溶液中依次发生反应的离子方程式为Fe2O3+6H+=2Fe3++3H2O、Cu2O+2H+===Cu+Cu2++H2O、2Fe3++Cu===2Fe2++Cu2+,反应后,过滤得到m(Cu)=3.2g,滤液中Fe2+有1.0mol,则参与反应的n(Cu)=0.5mol,所以反应中生成 Cu的物质的量为3.2/64+0.5=0.55mol,所以样品中n(Cu2O)=0.55mol;综上所述,本题答案是:0.55。

 名校课堂系列答案
名校课堂系列答案【题目】用图所示装置检验乙烯时不需要除杂的是
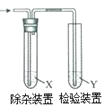
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
【题目】不锈钢表面用硝酸和氢氟酸的混酸处理后,产生的酸洗废液中含有Fe3+、Ni2+、NO3-、F-和+6价铬的含氧酸根离子等.如图是综合利用该酸洗废液的工艺流程:
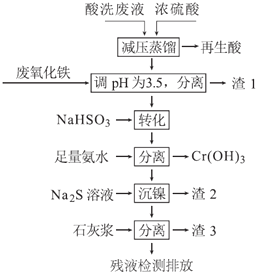
已知:
①金属离子开始沉淀和沉淀完全时的pH:
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
②Ni2+与足量氨水的反应为:Ni2++6NH3[Ni(NH3)6]2+
(1)再生酸中含有______,采取减压蒸馏的原因是______(用化学方程式表示).
(2)利用废氧化铁(主要成分为Fe2O3)代替烧碱调节pH的好处是______.
(3)请写出“转化”时NaHSO3与Cr2O72-发生反应的离子反应方程式:______.
(4)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:______.
(5)滤渣3的主要成分为Ca(OH)2和_________________________.
(6)经检测,最后的残液中c(Ca2+)=0.004molL-1,则残液中F-浓度为______mgL-1,[已知Ksp(CaF2)=4×10-11mol3L-3.