题目内容
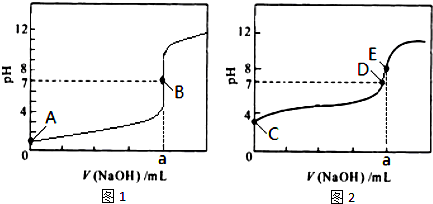
(1)常温下,用0.1000mol/LNaOH浴液分别滴定20.00mL0.1000mol/LHCl溶液和20.00mL 0.1000mol/LCH3COOH溶液,得到2条滴定曲线,如图所示.
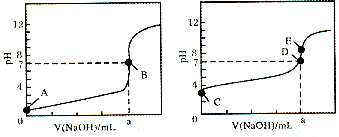
①由A、C点判断,滴定HCl溶液的曲线是
②a=
③c(Na+)=c(CH3COO-)的点是
④E点对应离子浓度由大到小的顺序为
(2)Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq)常温下,Cr(OH)3的溶度积Kap=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至

①由A、C点判断,滴定HCl溶液的曲线是
图1
图1
(填“图1”或“图2”);②a=
20
20
mL;③c(Na+)=c(CH3COO-)的点是
D
D
(填B、D或E);④E点对应离子浓度由大到小的顺序为
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
.(2)Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq)常温下,Cr(OH)3的溶度积Kap=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
5
5
.分析:(1)①氯化氢是强电解质,醋酸是弱电解质,等浓度的盐酸和醋酸,醋酸的pH大于盐酸;
②根据图1知,在盐酸溶液中,pH=7时,盐酸和氢氧化钠的物质的量相等;
③根据电荷守恒判断;
④根据溶液的酸碱性及电荷守恒判断离子浓度大小;
(2)根据溶度积常数及铬离子浓度计算溶液中氢氧根离子浓度,再根据水的离子积常数计算氢离子浓度,从而得出溶液的pH.
②根据图1知,在盐酸溶液中,pH=7时,盐酸和氢氧化钠的物质的量相等;
③根据电荷守恒判断;
④根据溶液的酸碱性及电荷守恒判断离子浓度大小;
(2)根据溶度积常数及铬离子浓度计算溶液中氢氧根离子浓度,再根据水的离子积常数计算氢离子浓度,从而得出溶液的pH.
解答:解:(1)①氯化氢是强电解质,醋酸是弱电解质,等浓度的盐酸和醋酸,醋酸的pH大于盐酸,根据图象知,未加氢氧化钠溶液时,图1的PH小于图2,所以图1是盐酸,故答案为:图1;
②根据图1知,在盐酸溶液中,pH=7时,盐酸和氢氧化钠的物质的量相等,盐酸和氢氧化钠的物质的量浓度相等,要使其物质的量相等,则体积必须相等,所以a=20mL,故答案为:20mL;
③溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),因为c(Na+)=c(CH3COO-),所以c(H+)=c(OH-),则溶液呈中性,为D点,故答案为:D;
④溶液呈碱性,c(H+)<c(OH-),溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以则c(Na+)>c(CH3COO-),溶液是盐溶液,所以c(CH3COO-)>c(OH-),则溶液中离子浓度大小顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(2)根据溶度积常数得溶液中c(OH-)=
=
mol/L=10-9 mol/L,则溶液中氢离子浓度=
mol/L=10-5 mol/L,则溶液的pH=5,
故答案为:5.
②根据图1知,在盐酸溶液中,pH=7时,盐酸和氢氧化钠的物质的量相等,盐酸和氢氧化钠的物质的量浓度相等,要使其物质的量相等,则体积必须相等,所以a=20mL,故答案为:20mL;
③溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),因为c(Na+)=c(CH3COO-),所以c(H+)=c(OH-),则溶液呈中性,为D点,故答案为:D;
④溶液呈碱性,c(H+)<c(OH-),溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以则c(Na+)>c(CH3COO-),溶液是盐溶液,所以c(CH3COO-)>c(OH-),则溶液中离子浓度大小顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(2)根据溶度积常数得溶液中c(OH-)=
| 3 |
| ||
| 3 |
| ||
| 10-14 |
| 10-9 |
故答案为:5.
点评:本题考查了酸碱混合溶液定性判断及溶度积常数的计算等知识点,明确弱电解质电离特点结合电荷守恒来分析解答即可,难度中等.

练习册系列答案
相关题目

 CH3COOH+OH-
CH3COOH+OH-