题目内容
(2011?杭州一模)食醋分为酿造醋和配制醋两种.国家标准规定酿造食醋总酸含量不得低于3.5g/100mL.
(1)某研究小组利用滴定分析法测定某品牌食醋中醋酸的含量,下列说法正确的是
a.用NaOH溶液滴定时反应的离子方程式为:H++OH-=H2O
b.食醋试样需稀释一定倍数后再进行滴定
c.用NaOH溶液滴定食醋,可使用酚酞或甲基橙作指示剂
d.若测得该品牌食醋的物质的量浓度为0.75mol?L-1,则该食醋的总酸量为4.5/100mL.
(2)研究小组的同学仔细观察了该品牌食醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与食品添加剂(苯甲酸钠C6H5COONa)不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的
a.pH b.电离度 c.电离常数 d.溶解度
(3)常温下,用0.1000mol?L-1NaOH溶液分别滴定20.00mL 0.1000mol?L-1HCl溶液和20.00mL 0.1000mol?L-1CH3COOH溶液,得到2条滴定曲线,如图所示.
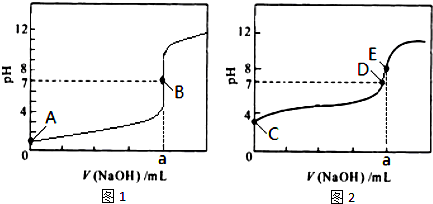
①滴定醋酸溶液的曲线是
②E点pH>8的原因用离子方程式表示
(4)现欲粗略测定一未知浓度的CH3COOH溶液的电离度,应做的实验和所需的试剂(试纸)是
a.电解,NaOH溶液 b.蒸馏,Na2CO3溶液
c.酯化反应,石蕊试液 d.中和滴定,pH试纸.
(1)某研究小组利用滴定分析法测定某品牌食醋中醋酸的含量,下列说法正确的是
bd
bd
.a.用NaOH溶液滴定时反应的离子方程式为:H++OH-=H2O
b.食醋试样需稀释一定倍数后再进行滴定
c.用NaOH溶液滴定食醋,可使用酚酞或甲基橙作指示剂
d.若测得该品牌食醋的物质的量浓度为0.75mol?L-1,则该食醋的总酸量为4.5/100mL.
(2)研究小组的同学仔细观察了该品牌食醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与食品添加剂(苯甲酸钠C6H5COONa)不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的
c
c
(填写序号).a.pH b.电离度 c.电离常数 d.溶解度
(3)常温下,用0.1000mol?L-1NaOH溶液分别滴定20.00mL 0.1000mol?L-1HCl溶液和20.00mL 0.1000mol?L-1CH3COOH溶液,得到2条滴定曲线,如图所示.

①滴定醋酸溶液的曲线是
图2
图2
(填“图l”或“图2”);滴定曲线中a=20.00
20.00
mL;②E点pH>8的原因用离子方程式表示
CH3COO-+H2O?CH3COOH+OH-
CH3COO-+H2O?CH3COOH+OH-
.(4)现欲粗略测定一未知浓度的CH3COOH溶液的电离度,应做的实验和所需的试剂(试纸)是
d
d
.a.电解,NaOH溶液 b.蒸馏,Na2CO3溶液
c.酯化反应,石蕊试液 d.中和滴定,pH试纸.
分析:(1)a.醋酸为弱电解质,离子方程式中应写为化学式;
b.实验时,为减小误差,应降低溶液的浓度;
c.不能用甲基橙为酸碱指示剂;
d.食醋的物质的量浓度为0.75mol?L-1,总酸量为0.75mol?L-1×60g/mol=45g/L,即4.5g/100mL;
(2)一定温度下,电离常数越大,酸性越强;
(3)醋酸为弱电解质,滴定终点时,溶液呈碱性;
(4)欲粗略测定一未知浓度的CH3COOH溶液的电离度,应分别测定c(CH3COOH)和c(H+).
b.实验时,为减小误差,应降低溶液的浓度;
c.不能用甲基橙为酸碱指示剂;
d.食醋的物质的量浓度为0.75mol?L-1,总酸量为0.75mol?L-1×60g/mol=45g/L,即4.5g/100mL;
(2)一定温度下,电离常数越大,酸性越强;
(3)醋酸为弱电解质,滴定终点时,溶液呈碱性;
(4)欲粗略测定一未知浓度的CH3COOH溶液的电离度,应分别测定c(CH3COOH)和c(H+).
解答:解:(1)a.醋酸为弱电解质,离子方程式应为CH3COOH+OH-=H2O,故a错误;
b.食醋试样需稀释一定倍数后再进行滴定,目的为减小实验误差,故b正确;
c.醋酸为弱电解质,滴定终点时,溶液呈碱性,不能用甲基橙为酸碱指示剂,否则误差较大,故c错误;
d.食醋的物质的量浓度为0.75mol?L-1,总酸量为0.75mol?L-1×60g/mol=45g/L,即4.5g/100mL,故d正确.
故答案为:bd;
(2)溶液的浓度不同,pH不同,无法确定酸性的强弱;而电离程度受溶液浓度的影响,一般不用于比较酸性的强弱,溶解度属于物理性质,与酸性的强弱无关,一定温度下,电离常数越大,酸性越强,故答案为:c;
(3)①醋酸为弱电解质,滴定过程中pH变化较盐酸缓慢,滴定终点时溶液呈碱性,则滴定醋酸溶液的曲线是图2,滴定终点时n(CH3COOH)=n(NaOH),则a=20.00mL,故答案为:图2;20.00;
②醋酸钠为强碱弱酸盐,溶液呈碱性,原因是CH3COO-+H2O?CH3COOH+OH-,故答案为:CH3COO-+H2O?CH3COOH+OH-;
(4)欲粗略测定一未知浓度的CH3COOH溶液的电离度,应分别测定c(CH3COOH)和c(H+),可通过中和滴定确定c(CH3COOH),通过pH试纸测定c(H+),故答案为:d.
b.食醋试样需稀释一定倍数后再进行滴定,目的为减小实验误差,故b正确;
c.醋酸为弱电解质,滴定终点时,溶液呈碱性,不能用甲基橙为酸碱指示剂,否则误差较大,故c错误;
d.食醋的物质的量浓度为0.75mol?L-1,总酸量为0.75mol?L-1×60g/mol=45g/L,即4.5g/100mL,故d正确.
故答案为:bd;
(2)溶液的浓度不同,pH不同,无法确定酸性的强弱;而电离程度受溶液浓度的影响,一般不用于比较酸性的强弱,溶解度属于物理性质,与酸性的强弱无关,一定温度下,电离常数越大,酸性越强,故答案为:c;
(3)①醋酸为弱电解质,滴定过程中pH变化较盐酸缓慢,滴定终点时溶液呈碱性,则滴定醋酸溶液的曲线是图2,滴定终点时n(CH3COOH)=n(NaOH),则a=20.00mL,故答案为:图2;20.00;
②醋酸钠为强碱弱酸盐,溶液呈碱性,原因是CH3COO-+H2O?CH3COOH+OH-,故答案为:CH3COO-+H2O?CH3COOH+OH-;
(4)欲粗略测定一未知浓度的CH3COOH溶液的电离度,应分别测定c(CH3COOH)和c(H+),可通过中和滴定确定c(CH3COOH),通过pH试纸测定c(H+),故答案为:d.
点评:本题综合考查物质的含量测定、酸碱混合的定性判断和计算以及弱电解质的电离和盐类的水解等知识,题目难度中等,但信息量较大,答题时注意审题.

练习册系列答案
相关题目
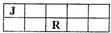 (2011?杭州一模)J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表.已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素.下列说法错误的是( )
(2011?杭州一模)J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表.已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素.下列说法错误的是( )