题目内容
200℃时,11.6 g CO2和H2O的混合物气体与足量的Na2O2反应,反应后固体增加了3.6g,则原混合物的平均式量为( )
| A.5.8 | B.11.6 | C.23.2 | D.46.4 |
C
设CO2和H2O的物质的量分别是x和y,则根据反应的方程式2Na2O2+2CO2=2Na2CO3+O2↑、2Na2O2+2H2O=4NaOH+O2↑可知,28x+2y=3.6g。又因为44x+18y=11.6g,所以16x+16y=11.6g-3.6g=8.0g。因此x+y=0.5mol,所以原混合物的平均式量为11.6÷(x+y)=23.2,答案选C。

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
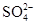 的总物质的量为0.9 mol
的总物质的量为0.9 mol