题目内容
【题目】某研究性学习小组设计了一组实验验证元素周期律。
Ⅰ.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成元素氮、碳、硅非金属性强弱比较的实验研究。已知A是强酸,B是块状固体。打开分液漏斗的活塞后,可看到有大量气泡产生,烧杯中可观察到白色沉淀生成。
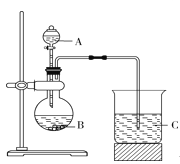
(1)甲同学设计实验的理论依据是_________________。
(2)写出选用的物质:A____________,B____________,C________(填化学式)。
(3)烧杯中反应的离子方程式为______________________。
(4)乙同学认为甲同学设计的实验不够严谨,应在B和C之间增加一个洗气装置,该装置中应盛放________(填试剂名称)溶液,目的是_____________________。
Ⅱ.丙同学设计了如图装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
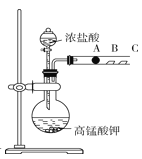
(5)A处的实验现象为_________;写出B处反应的离子方程式:____________;向NaBr和KI的混合溶液中,通入足量的Cl2充分反应后,将所得溶液蒸干并灼烧,最后得到的物质是_________。
(6)丙同学利用此实验证明卤素单质氧化性Cl2>Br2>I2,你认为此实验_____(填“合理”或“不合理”),理由是_______。
【答案】(1) 强酸制弱酸 (2)HNO3 CaCO3Na2SiO3
(3)CO2 + SiO32―+ H2O = H2SiO3↓+ CO32―或2CO2 + SiO32―+ 2H2O = H2SiO3↓+ 2HCO3―
(4) 碳酸氢钠吸收挥发出来的硝酸,避免干扰
(5) 棉花由白色变为橙黄色 2I-+Cl2=2Cl-+I2 NaCl和KCl (6)不合理 不能验证Br2和I2的氧化性强弱
【解析】
试题(1)根据元素非金属性与对应最高价含氧酸之间的关系,比较最高价含氧酸的酸性强弱,根据甲设计的实验装置图可知,其实验的原理是利用较强酸制较弱酸。
(2)氮、碳、硅对应的酸是硝酸、碳酸及硅酸,利用强酸与弱酸盐反应制弱酸,故实验A、B、C中的试剂分别是稀硝酸、碳酸钙、硅酸钠溶液。
(3)有关反应的离子方程式分别是CaCO3+2H+===Ca2++2CO2↑+H2O、![]() ,故烧杯中发生第二步反应。
,故烧杯中发生第二步反应。
(4)挥发出来的硝酸,会干扰实验,故应加一个饱和碳酸氢钠除杂质。
(5)高锰酸钾与盐酸制备了氯气,被棉花吸收,变成橙黄色;B处反应的离子方程式是2I-+Cl2=2Cl-+I2,向NaBr和KI的混合溶液中,通入足量的Cl2充分反应后,将所得溶液蒸干并灼烧,溴化钠变成溴,加热挥发了,碘化钾变成碘,升华了,最后得到的物质是NaCl和KCl。
(6)有氯气存在,不能验证Br2和I2的氧化性强弱。