题目内容
决定物质性质的重要因素是物质结构。请回答下列问题。
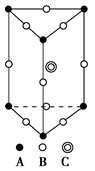
(1)下图是石墨的结构,其晶体中存在的作用力有 (填序号)
Aσ键;Bπ键;C氢键;D配位键;E分子间作用力;F金属键;G离子键
(2)下面关于晶体的说法不正确的是___________
(3)CaF2结构如图Ⅰ所示,Cu形成晶体的结构如Ⅲ所示,Ⅱ为H3BO3晶体结构图(层状结构,层内的H3BO3分子通过氢键结合) 
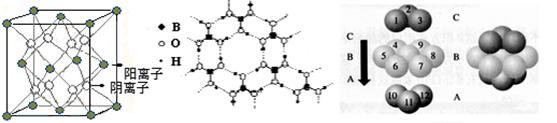
图Ⅰ 图Ⅱ 图Ⅲ
① 图I所示的晶体中与Ca2+离子最近且等距离的Ca2+离子数为 ,
图III中未标号的Cu原子形成晶体后周围最紧邻的Cu原子数为 ;
②H3BO3晶体中B原子杂化方式______ ;
③三种晶体中熔点高低的顺序为 (填化学式),H3BO3晶体受热熔化时,克服的微粒之间的相互作用为
(4) 碳的某种单质的晶胞如图所示,一个晶胞中有_____个碳原子;若该晶体的密度为ρ g/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个碳原子之间的距离为_ ____cm(用代数式表示)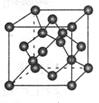
(1)下图是石墨的结构,其晶体中存在的作用力有 (填序号)

Aσ键;Bπ键;C氢键;D配位键;E分子间作用力;F金属键;G离子键
(2)下面关于晶体的说法不正确的是___________
| A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4 |
| B.硬度由大到小:金刚石>碳化硅>晶体硅 |
| C.熔点由高到低:Na>Mg>Al |
| D.晶格能由大到小:NaF> NaCl> NaBr>NaI |


图Ⅰ 图Ⅱ 图Ⅲ
① 图I所示的晶体中与Ca2+离子最近且等距离的Ca2+离子数为 ,
图III中未标号的Cu原子形成晶体后周围最紧邻的Cu原子数为 ;
②H3BO3晶体中B原子杂化方式______ ;
③三种晶体中熔点高低的顺序为 (填化学式),H3BO3晶体受热熔化时,克服的微粒之间的相互作用为
(4) 碳的某种单质的晶胞如图所示,一个晶胞中有_____个碳原子;若该晶体的密度为ρ g/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个碳原子之间的距离为_ ____cm(用代数式表示)

(1)A B E(2分)
(2)C (1分)
(3)①12 (2分) 12 (2分)
②sp2(1分)
③CaF2 > Cu >H3BO3(2分)
分子间作用力(1分)
(4)8个 (2分)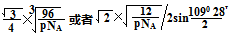 (2分)
(2分)
(2)C (1分)
(3)①12 (2分) 12 (2分)
②sp2(1分)
③CaF2 > Cu >H3BO3(2分)
分子间作用力(1分)
(4)8个 (2分)
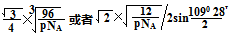 (2分)
(2分)试题分析:(1)石墨属于混合晶体,是层状结构,每一层里是碳原子之间形成的共价键;在其层状结构中碳碳键键角为120°,每个碳原子都结合着3个碳原子,碳原子采取sp2杂化,3个杂化轨道用来形成σ键结合其他碳原子,所有碳原子剩余2p轨道一同形成离域大π键。层与层之间是依靠分子间作用力(即范德华力)相连接的。
(2)同周期金属元素的熔点随原子序数增加,熔点由高到低的顺序是Al>Na>Mg,所以C错。
(3)①由图I可以看出晶体中与F离子最近且等距离的F离子数为
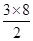 =12,由图III中未标号的G原子形成晶体后周围最紧邻的G原子数为3+6+3=12,故答案为:12;12;
=12,由图III中未标号的G原子形成晶体后周围最紧邻的G原子数为3+6+3=12,故答案为:12;12;②B原子都含有3个共价单键,所以采用sp2杂化;
③CaF2属于离子晶体,Cu 属于金属晶体,H3BO3属于分子晶体,不同类型晶体熔沸点判断一般来说按照原子晶体>离子晶体>分子晶体;金属晶体(除少数外)>分子晶体,H3BO3属于分子晶体,晶体受热熔化时,克服的微粒之间的相互作用为分子间作用力。
(4)晶胞中碳原子个数按照顶点8个×
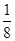 +面心6个×
+面心6个×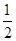 +体心3个×1=8个
+体心3个×1=8个 假设晶胞的边长为acm 晶胞的体积为a3 cm3, 晶体中最近的两个碳原子之间的距离为a
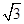 /4.
/4. ρ·a3/8=12/NA.a3=(8×1/2)/ρ·NA.所以a=
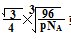

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目