题目内容
【题目】红矾钠(Na2Cr2O7·2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO·Cr2O3)制备红矾钠的过程中会发生如下反应:4FeO(s)+4Cr2O3(s)+8Na2CO3(s)+7O2(g) ![]() 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
(1)请写出上述反应的化学平衡常数表达式:K=__________________。
(2)图1、图2表示上述反应在t1时达到平衡、在t2时因改变某个条件而发生变化的曲线。由图1判断,反应进行至t2时,曲线发生变化的原因是___________________(用文字表达);由图2判断,t2到t3的曲线变化的原因可能是________(填写序号)。
a.升高温度 b.加催化剂 c.通入O2 d.缩小容器体积

(3)工业上可用上述反应中的副产物CO2来生产甲醇:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①已知该反应能自发进行,则下列图像正确的是___________。

②在T1温度时,将1 mol CO2和3 mol H2充入一密闭容器中,反应达到平衡后,CO2转化率为α,则容器内平衡时的压强与起始压强之比为________。
【答案】 ![]() 对平衡体系降温,平衡正向移动,CO2浓度增大,O2浓度减小 b AC (1-0.5α)∶1
对平衡体系降温,平衡正向移动,CO2浓度增大,O2浓度减小 b AC (1-0.5α)∶1
【解析】(1)4FeO(s)+4Cr2O3(s)+8Na2CO3(s)+7O2(g)8Na2CrO4(s)+2Fe2O3(s)+8CO2(g)的化学平衡常数表达式K=![]() 。
。
(2)图1中t2时改变条件瞬间,CO2浓度增大,O2浓度减小,由4FeO(s)+4Cr2O3(s)+8Na2CO3(s)+7O2(g) ![]() 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0知体系为放热反应,不能是改变浓度或改变压强,而后平衡正向移动,正反应为放热反应,降低温度平衡正向移动;图2中t2到t3的曲线变化说明平衡没有移动,只是反应速率加快,正反应为气体体积增大的放热反应,应是使用催化剂;所以选b。
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0知体系为放热反应,不能是改变浓度或改变压强,而后平衡正向移动,正反应为放热反应,降低温度平衡正向移动;图2中t2到t3的曲线变化说明平衡没有移动,只是反应速率加快,正反应为气体体积增大的放热反应,应是使用催化剂;所以选b。
(3)①反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)是熵减小的反应,△H﹣T△S<0能够自发进行,则正反应为放热反应;A.升温平衡逆向移动,平衡常数随温度的升高而减小,故A正确;
B.升温化学反应速率加快,故B错误;C.达平衡后再升温,平衡逆向移动,甲醇浓度减小,故C正确;D.达平衡后再升温,平衡逆向移动,氢气体积分数增大,故D错误;故答案为AC。
②反应达到平衡后,若CO2转化率为a,则:
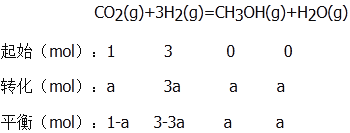
根据相同条件下气体的压强之比等于物质的量之比,即(1-a+3-3a+a+a):(1+3)=(1-0.5a):1。

 阅读快车系列答案
阅读快车系列答案【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照以下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2%H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是______________________。
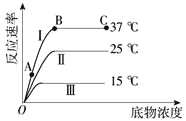
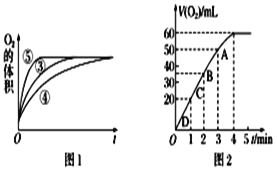
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1。分析图1能够得出的实验结论是(Ⅰ)____________。(Ⅱ)_____________。
(3)加入0.1 g MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示。反应速率逐渐变化的原因是________________。
【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是![]() ,并含少量的
,并含少量的![]() 、
、![]() 、MgO、CaO等,生产工艺流程图如下:
、MgO、CaO等,生产工艺流程图如下:
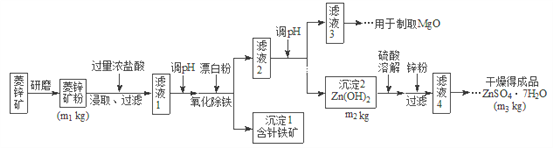
(1)将菱锌矿研磨成粉的目的是_______________。
(2)写出Fe3+水解的离子方程式_________________。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为__________。
沉淀化学式 |
|
|
|
|
开始沉淀的pH |
|
|
|
|
沉淀完全的pH |
|
|
|
|
开始溶解的pH |
|
|
|
|
Ksp |
|
|
|
|
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是________选填序号。
![]() 大理石粉
大理石粉 ![]() 石灰乳 c纯碱溶液 d氨水
石灰乳 c纯碱溶液 d氨水
(5)“滤液4”之后的操作依次为________、_______、过滤,洗涤,干燥。
(6)分析图中数据,菱锌矿粉中![]() 的质量分数不低于__________用代数式表示
的质量分数不低于__________用代数式表示