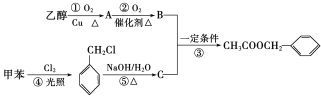
题目内容
【题目】氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺(NH2Cl)、二氯胺(NHCl2)和三氯胺(NCl3)。氯胺消毒时首先发生水解,生成具有强烈杀菌作用的次氯酸。
(1)NH2Cl中氯元素的化合价为___________,其电子式为__________。
(2)NH2Cl水解的离子方程式为____________。
(3)三氯胺在常温下为黄色黏稠的油状液体,有毒,在弱酸性溶液中稳定性较好。将0.01 mol NCl3通入100mL0.5mol/LNa2S03溶液中,转移电子的物质的量为___________。
(4)己知:2NH3(g)+3C12(g)=N2(g)+6HCl(g)△H1=-469kJ/mol
N2(g)+3C12(g)=2NC13(g) △H2=+520kJ/mol
NH3(g)+3C12(g)= NC13(g)+ 3HCl(g)△H3
则△H3=__________kJ/mol
【答案】⑴+1(1分) ![]() (2分)
(2分)
⑵ NH2Cl + 2H2O![]() NH3·H2O + HClO(2分)
NH3·H2O + HClO(2分)
⑶ 0.06(2分) ⑷ +25.5(2分)
【解析】
试题分析:(1)N元素是-3价,则根据正负价代数和为0可知 NH2Cl中氯元素的化合价为+1价,其电子式为![]() 。
。
(2) NH2Cl水解生成氨水和次氯酸,其水解的离子方程式为NH2Cl+2H2O![]() NH3·H2O+HClO。
NH3·H2O+HClO。
(3)三氯胺中氯元素是+1价,反应后变为-1价,所以0.01mol NCl3通入100mL0.5mol/LNa2SO3溶液中,转移电子的物质的量为0.01mol×6=0.06mol。
(4)已知:①2NH3(g)+ 3Cl2(g)=N2(g)+ 6HCl(g) △H1=-469kJ·mol-1
②N2(g)+ 3Cl2(g)=2NC13(g) △H2=+520kJ·mol-1
则根据盖斯定律可知(②-①)÷2即得到反应2NH3(g)+3Cl2(g)=NC13(g)+3HCl(g)的△H3=+25.5 kJ·mol-1。

【题目】实验室中某些气体的制取、收集及尾气处理装里如图所示(省略了净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
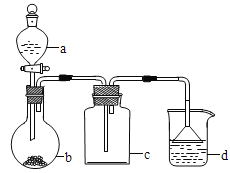
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 氯化按 | NaOH | NH3 | H2O |
B | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
【题目】X、Y、Z、W代表短周期的四种元素,有关它们的部分信息如下表所示:
元素 | 部分结构特点 | 部分性质 |
X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2等 |
Y | Y原子的次外层电子数等于最外层电子数的一半 | Y元素能形成多种单质 |
Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价的代数和等于6 |
W | 第三周期元素的简单离子中半径最小 | W的单质化学性质虽较活泼,但只需常温保存 |
请按要求回答下列问题(注意不能用字母X、Y、Z、W作答,请用相应的元素符号或化学式填写):
(1)X的元素名称是 ,X的气态氢化物的电子式是 。
(2)Z元素在周期表中的位置是第 周期,第 族。Z和W形成的化合物属于 化合物(填“离子”或“共价”)。
(3)X、Y、Z、W的原子半径从大到小的顺序是 。
(4)X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是: 。
(5)铜和X的最高价氧化物的水化物的浓溶液反应的化学方程式: 。
(6)气体分子(YX)2称为拟卤素,性质与卤素类似,请写出(YX)2与NaOH溶液反应的化学方程式: 。