��Ŀ����
���û�ѧ��Ӧԭ���о���������þ��ͭ��Ԫ�ؼ��仯��������ʡ�
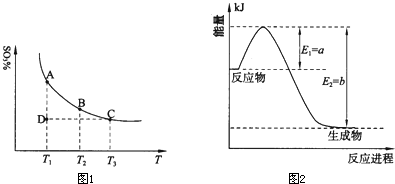
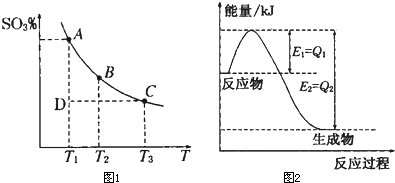
�źϳɰ���Ӧ��Ӧ��N2(g)+3H2(g) 2NH3(g)����H=-QkJ/mol�����ں��¡���ѹ��������ƽ����ϵ��ͨ���������û�ѧ��Ӧƽ���ƶ� ����������ҡ���������ʹ�ô������Լӿ췴Ӧ���ʣ���ߺϳɰ���ҵ�İ�����������÷�Ӧ�Ħ�H ���������С�����ı䡱����
2NH3(g)����H=-QkJ/mol�����ں��¡���ѹ��������ƽ����ϵ��ͨ���������û�ѧ��Ӧƽ���ƶ� ����������ҡ���������ʹ�ô������Լӿ췴Ӧ���ʣ���ߺϳɰ���ҵ�İ�����������÷�Ӧ�Ħ�H ���������С�����ı䡱����
 ����25���£���aL��0.01mol��L-1�İ�ˮ���뵽1L��0.01mol��L-1��������Һ�У�����Ӧ����Һ��c(NH4��)>c(Cl-)������Һ��____�ԣ���ᡱ������С�������a>1����Ӧ������Һ����������Ũ�ȱȽϿ�����ȷ����
����25���£���aL��0.01mol��L-1�İ�ˮ���뵽1L��0.01mol��L-1��������Һ�У�����Ӧ����Һ��c(NH4��)>c(Cl-)������Һ��____�ԣ���ᡱ������С�������a>1����Ӧ������Һ����������Ũ�ȱȽϿ�����ȷ����
��Cl->H+>NH4+>OH-����Cl->NH4+>H+>OH-����Cl-=NH4+>H+=OH-����NH4+>Cl->OH->H+
����25���£���Ũ�Ⱦ�Ϊ0.1mol��L-1��MgCl2��CuCl2�����Һ����μ��백ˮ������
��_______�������ѧʽ�������ɸó��������ӷ���ʽΪ_________________________����
���μӰ�ˮ�����һ�������ķ�Ӧ�����ӷ�Ӧ����ʽ
�ο����ݣ�25�棬Ksp[Mg(OH)2]=1.8��10-11��KsP[Cu(OH)2]=2.2��10-20��
����������Ѱ����ʵĴ����͵缫���ϣ���N2��H2Ϊ�缫��Ӧ���HCl-NH4ClΪ��
������Һ�����Ʊ�����ȼ�ϵ�ء����ȼ�ϵ�ظ���������pH____�����������С�����䡱���������ĵ缫��Ӧ����ʽΪ________ _____
������(1/) ���ı�(1/)
�Ƽ�(1/) �ڢۢ�(2/)
��Cu(OH)2(2/)
Cu2++2NH3��H2O=Cu(OH)2��+2NH4+(2/)
Cu(OH)2+4NH3��H2O=Cu(NH3)42++2OH-+4H2O(2/)
�ȼ�С(1/) N2+6e��+6H+=2NH4+
����������

 ���ݼ���ϵ�д�
���ݼ���ϵ�д�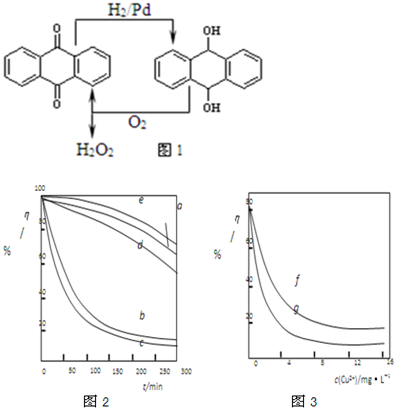
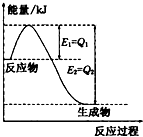 ���û�ѧ��Ӧԭ���о������ȡ���ȵ��ʼ��仯����ķ�Ӧ����Ҫ���壮
���û�ѧ��Ӧԭ���о������ȡ���ȵ��ʼ��仯����ķ�Ӧ����Ҫ���壮