题目内容
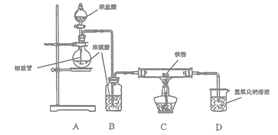
【题目】已知A为常见的金属单质,根据下图所示的关系:

(1)确定A、B、C、F的化学式,A为________,B为________,C为________,F为________。
(2)写出⑧的化学方程式,④、⑤的离子方程式。
⑧_________________________________________________。
④________________________________________________。
⑤___________________________________________________。
【答案】Fe Fe3O4 FeCl2 Fe(OH)3 4Fe(OH)2+O2+2H2O===4Fe(OH)3 2Fe2++Cl2===2Cl-+2Fe3+ Fe+2Fe3+===3Fe2+
【解析】
红褐色固体为氢氧化铁,说明转化关系中含有铁元素,则A为铁。B为黑色晶体,为四氧化三铁。结合转化关系图解答。
红褐色固体为氢氧化铁,说明转化关系中含有铁元素,则A为铁。B为黑色晶体,为四氧化三铁,B和盐酸反应生成氯化亚铁和氯化铁,根据转化关系分析,D为氯化铁,C为氯化亚铁,E为氢氧化亚铁。则
(1)根据以上分析,A为Fe,B为Fe3O4,C为FeCl2,F为Fe(OH)3;
(2)反应⑧为氢氧化亚铁和氧气、水反应生成氢氧化铁,方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
反应④为亚铁离子被氯气氧化生成铁离子,离子方程式为:2Fe2++Cl2=2Fe3++2Cl—;
反应⑤为铁离子变成亚铁离子,离子方程式为:2Fe3++Fe=3Fe2+。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目