题目内容
8分)一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8 mol NO2,发生如下反应:2NO2(红棕色)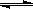 N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
(1)在该温度下,反应的化学平衡常数表达式为:
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: mol·L-1·s-1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:
(4)t1时,正反应速率 (填“>”、“<”或“=”)逆反应速率
(5)维持容器的温度不变,若缩小容器的体积,则平衡向 移动
(填“正反应方向”、“逆反应方向”或“不移动”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色
(填“变深”、“变浅”或“不变”)
(1)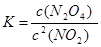 (2分) (2)0.1(2分)(3)t3 (1分)
(2分) (2)0.1(2分)(3)t3 (1分)
(4) > (1分)(5)正反应应方向(1分)(6)变深 (1分)
【解析】(1)平衡常数是指在一定条件下的可逆反应中,当反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以该反应的平衡常数表达式为 。
。
(2)从t1至t2时N2O4的物质的量增加了4mol-3mol=1mol,所以反应速率是1mol÷1L÷10s=0.1mol/(L·s)。
(3)根据图像可知,t3时刻物质的物质的量不再发生变化,所以此时反应达到平衡状态。
(4)t1时NO2的物质的量逐渐减小,说明反应是向正反应方向进行的,即正反应速率大于逆反应速率。
(5)反应前后是体积减小的,所以缩小容积,压强增大,平衡向正反应方向移动,
(6)正反应是放热反应,所以升高温度,平衡向逆反应方向移动,NO2的浓度增大,颜色变深。

(8分)(2011·苏北四市调研)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气,反应为:
C(s)+H2O(g) CO(g)+H2(g)
ΔH=+131.3 kJ·mol-1,
ΔS=+133.7 J·(K·mol)-1
①该反应能否自发进行与________有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母,下同)。
a.容器中的压强不变
b.1 mol H—H键断裂的同时断裂2 mol H—O键
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
| 实验 组 | 温度/ ℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验1中以v(H2)表示的反应速率为_________________________________________。
②若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是________(用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),右图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中能使c(CH3OH)增大的是________。
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1 mol CO2和3 mol H2
(8分)(2011·苏北四市调研)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气,反应为:
C(s)+H2O(g)  CO(g)+H2(g)
CO(g)+H2(g)
ΔH=+131.3 kJ·mol-1,
ΔS=+133.7 J·(K·mol)-1
①该反应能否自发进行与________有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母,下同)。
a.容器中的压强不变
b.1 mol H—H键断裂的同时断裂2 mol H—O键
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应
CO(g)+H2O(g)  CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
|
实验 组 |
温度/ ℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
|
H2O |
CO |
H2 |
CO2 |
|||
|
1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
|
2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
|
3 |
900 |
a |
b |
c |
d |
t |
①实验1中以v(H2)表示的反应速率为_________________________________________。
②若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3 min,则a、b应满足的关系是________(用含a、b的数学式表示)。

(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g),右图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中能使c(CH3OH)增大的是________。
CH3OH(g)+H2O(g),右图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中能使c(CH3OH)增大的是________。
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1 mol CO2和3 mol H2

 N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答: