题目内容
(2009?徐州三模)控制、治理氮氧化物对大气的污染是改善大气质量的重要方面.
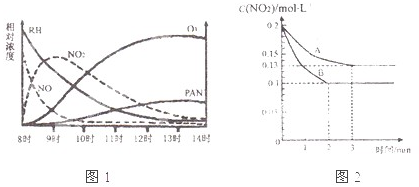
(1)光化学烟雾白天生成,傍晚消失,其主要成分为RH(烃)、NO、NO2、O3、PAN(CH3COOONO2),某地早上至中午这些物质的相对浓度变化如图1所示,则下列叙述合理的是
a.早上8时交通繁忙期,光化学烟雾的主要成分为RH、NO
b.14时,光化学烟雾的主要成分为O3、PAN
c.PAN、O3由RH和NO直接反应生成
d.PAN直接由O3转化生成
(2)火力发电厂的燃煤排烟中含大量的氮氧化物(NOx),可利用甲烷和NOx在一定条件下反应消除其污染,则CH4与NO2反应的化学方程式为
(3)在一密闭容器中发生反应2NO2 ?2NO+O2,反应过程中NO2的浓度随时间变化的情况如图2所示.请回答:
①依曲线A,反应在前3min内氧气的平均反应速率为
②若曲线A、B分别表示的是该反应在某不同条件下的反应情况,则此条件是
③曲线A、B分剐对应的反应平衡常数的大小关系是KA
(4)一定温度下,在一密闭容器中N2O5可发生下列反应:
2N2O5(g)?4NO2(g)+O2(g)I
2NO2(g)?2NO(g)+O2(g)II
则反应I的平衡常数表达式为
.若达平衡时,c(NO2)=0.4mol?L-1,c(O2)=1.3mol?L-1,则反应II中NO2的转化率为

(1)光化学烟雾白天生成,傍晚消失,其主要成分为RH(烃)、NO、NO2、O3、PAN(CH3COOONO2),某地早上至中午这些物质的相对浓度变化如图1所示,则下列叙述合理的是
a.b
a.b
.(填字母)a.早上8时交通繁忙期,光化学烟雾的主要成分为RH、NO
b.14时,光化学烟雾的主要成分为O3、PAN
c.PAN、O3由RH和NO直接反应生成
d.PAN直接由O3转化生成
(2)火力发电厂的燃煤排烟中含大量的氮氧化物(NOx),可利用甲烷和NOx在一定条件下反应消除其污染,则CH4与NO2反应的化学方程式为
CH4+2NO2=N2+CO2+2H2O
CH4+2NO2=N2+CO2+2H2O
.(3)在一密闭容器中发生反应2NO2 ?2NO+O2,反应过程中NO2的浓度随时间变化的情况如图2所示.请回答:
①依曲线A,反应在前3min内氧气的平均反应速率为
0.0117mol/(L?min)
0.0117mol/(L?min)
.②若曲线A、B分别表示的是该反应在某不同条件下的反应情况,则此条件是
温度
温度
(填“浓度”、“压强”、“温度”或“催化剂”).③曲线A、B分剐对应的反应平衡常数的大小关系是KA
<
<
KB.(填“>”、“<”或“=”)(4)一定温度下,在一密闭容器中N2O5可发生下列反应:
2N2O5(g)?4NO2(g)+O2(g)I
2NO2(g)?2NO(g)+O2(g)II
则反应I的平衡常数表达式为
| C4(NO2)C(O2) |
| C2(N2O5) |
| C4(NO2)C(O2) |
| C2(N2O5) |
80%
80%
,N2O5(g)的起始浓度应不低于1
1
mol?L-1.分析:(1)a.由图1可知早上8时光化学烟雾的主要成分为RH、NO;
b.由图1可知14时,光化学烟雾的主要成分为O3、PAN;
c.根据质量守恒判断;
d.O3的浓度一直在减少不可能是反应物;
(2)甲烷和NOx在一定条件下反应消除其污染,生成N2和CO2;
(3)①根据变化的浓度之比等于化学计量数之比以及反应速率公式v=
来计算;
②由图象曲线A、B的变化可知,曲线B到达平衡时间较曲线A短,反应速率快,平衡时CD2浓度较曲线A低,转化率高;
③由②分析可知,曲线B的温度比曲线A的温度高,该反应为吸热反应,升高温度,平衡向正反应移动,平衡常数增大;
(4)平衡常数表达式K=
;
设出反应I和反应II产生的氧气的浓度分别为Xmol?L-1,Y mol?L-1,然后依据方程组建立关系求解,得出反应II中NO2的转化率和N2O5(g)的起始浓度.
b.由图1可知14时,光化学烟雾的主要成分为O3、PAN;
c.根据质量守恒判断;
d.O3的浓度一直在减少不可能是反应物;
(2)甲烷和NOx在一定条件下反应消除其污染,生成N2和CO2;
(3)①根据变化的浓度之比等于化学计量数之比以及反应速率公式v=
| △c |
| △t |
②由图象曲线A、B的变化可知,曲线B到达平衡时间较曲线A短,反应速率快,平衡时CD2浓度较曲线A低,转化率高;
③由②分析可知,曲线B的温度比曲线A的温度高,该反应为吸热反应,升高温度,平衡向正反应移动,平衡常数增大;
(4)平衡常数表达式K=
| C4(NO2)C(O2) |
| C2(N2O5) |
设出反应I和反应II产生的氧气的浓度分别为Xmol?L-1,Y mol?L-1,然后依据方程组建立关系求解,得出反应II中NO2的转化率和N2O5(g)的起始浓度.
解答:解:(1)a.由图1早上8时光化学烟雾的主要成分为RH、NO,故a正确;
b.由图1可知14时,光化学烟雾的主要成分为O3、PAN,故b正确;
c.根据质量守恒可知,氧元素质量不守恒,故c错误;
d.O3的浓度一直在减少不可能是反应物,故d错误;
故选:a.b;
(2)甲烷和NOx在一定条件下反应消除其污染,生成无毒物质N2和CO2、水,反应方程式为2NO2+CH4═N2+CO2+2H2O,故答案为:2NO2+CH4═N2+CO2+2H2O;
(3)①由图曲线A可知,3min内浓度NO2变化为0.2mol/L-0.13mol/L=0.07mol/L,由方程式可知△c(D2)=
×0.07mol/L=0.035mol/L,所以3min内v(D2)=
=0.0117mol/(L?min),故答案为:0.0117mol/(L?min);
②该反应为体积减小的吸热反应,增大NO2浓度,反应加快,但NO2转化率降低;增大压强,反应加快,但NO2转化率降低;使用催化剂,反应加快,转化率不变;升高温度,反应加快,平衡向正反应方向移动,NO2转化率增大.故为升高温度,故答案为:温度;
③由②分析可知,曲线B的温度比曲线A的温度高,该反应为吸热反应,升高温度,平衡向正反应移动,平衡常数增大,即KA<KB,故答案为:<;
(4)平衡常数表达式K=
,故答案为:
2N2O5(g)?4NO2(g)+O2(g)
2X 4Xmol?L-1 Xmol?L-1
2NO2(g)?2NO(g)+O2(g)
2Ymol?L-1 Ymol?L-1
则建立关系:X+Y=1.3;4X-2Y=0.4;解得:X=0.5;Y=0.8;
反应II中NO2的转化率为
×100%=80%,N2O5(g)的起始浓度应不低于1mol?L-1,故答案为:
;80%;1.
b.由图1可知14时,光化学烟雾的主要成分为O3、PAN,故b正确;
c.根据质量守恒可知,氧元素质量不守恒,故c错误;
d.O3的浓度一直在减少不可能是反应物,故d错误;
故选:a.b;
(2)甲烷和NOx在一定条件下反应消除其污染,生成无毒物质N2和CO2、水,反应方程式为2NO2+CH4═N2+CO2+2H2O,故答案为:2NO2+CH4═N2+CO2+2H2O;
(3)①由图曲线A可知,3min内浓度NO2变化为0.2mol/L-0.13mol/L=0.07mol/L,由方程式可知△c(D2)=
| 1 |
| 2 |
| 0.035mol /L |
| 3min |
②该反应为体积减小的吸热反应,增大NO2浓度,反应加快,但NO2转化率降低;增大压强,反应加快,但NO2转化率降低;使用催化剂,反应加快,转化率不变;升高温度,反应加快,平衡向正反应方向移动,NO2转化率增大.故为升高温度,故答案为:温度;
③由②分析可知,曲线B的温度比曲线A的温度高,该反应为吸热反应,升高温度,平衡向正反应移动,平衡常数增大,即KA<KB,故答案为:<;
(4)平衡常数表达式K=
| C4(NO2)C(O2) |
| C2(N2O5) |
| C4(NO2)C(O2) |
| C2(N2O5) |
2N2O5(g)?4NO2(g)+O2(g)
2X 4Xmol?L-1 Xmol?L-1
2NO2(g)?2NO(g)+O2(g)
2Ymol?L-1 Ymol?L-1
则建立关系:X+Y=1.3;4X-2Y=0.4;解得:X=0.5;Y=0.8;
反应II中NO2的转化率为
| 1.6mo1?L -1 |
| 2mo1?L -1 |
| C4(NO2)C(O2) |
| C2(N2O5) |
点评:本题主要考查了化学反应速率、化学平衡等知识点,平时还考查了学生的审题能力,培养了学生分析问题、解决问题的能力.

练习册系列答案
相关题目
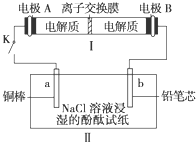 (2009?徐州三模)如图所示装置I是一种可充电电池,装置Ⅱ为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3
(2009?徐州三模)如图所示装置I是一种可充电电池,装置Ⅱ为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3 (2009?徐州二模)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(2009?徐州二模)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.