题目内容
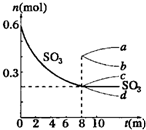 在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示:
在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示:(1)写出该反应的平衡常数表达式
| C2(SO2)C(O2) |
| C2(SO3) |
| C2(SO2)C(O2) |
| C2(SO3) |
(2)用O2表示0~8min内该反应的平均速率v=
0.0125mol/(L?min)
0.0125mol/(L?min)
.(3)升高温度,该反应的反应速率将
增大
增大
;K值将增大
增大
;容器中气体的平均相对分子质量将减小
减小
.(填“增大”“减小”或“不变”)(4)能说明该反应已达到平衡状态的是
b、c
b、c
a.v(SO3)=2v(O2) b.容器内压强保持不变 c.v逆(SO2)=2v正(O2) d.容器内密度保持不变
(5)从8min起,压缩容器为1L,则SO3的变化曲线为
c
c
A. a B. b C. c D. d.
分析:(1)根据平衡常数的概念;
(2)根据v=
=
=求出v(SO3),再利用速率之比等于化学计量数之比,计算v(O2);
(3)根据温度对反应速率、化学平衡的影响分析;
(4)反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断;
(5)根据压强对化学平衡的影响分析.
(2)根据v=
| △c |
| △t |
| ||
| △t |
(3)根据温度对反应速率、化学平衡的影响分析;
(4)反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断;
(5)根据压强对化学平衡的影响分析.
解答:解:(1)该反应的平衡常数表达式为K=
,故答案为:
;
(2)根据v=
=
=
=0.025mol/(L?min),速率之比等于化学计量数之比,所以有:v(O2)=
v(SO2)=0.0125mol/(L?min),
故答案为:0.0125mol/(L?min);
(3)温度升高,反应速率增大;温度升高,化学平衡正向移动,生成物的浓度增大,反应物的浓度减少,平衡常数增大;温度升高,化学平衡正向移动,混合气体的总物质的量增大,质量不变,摩尔质量减少,即平均相对分子质量减少;故答案为:增大;增大;减小;
(4)a、表示同一方向反应速率,v(SO2)自始至终为v(O2)的2倍,不能说明达到平衡,故a错误;
b、该反应前后气体体积变化,所以压强不变,反应已达到平衡状态,故b正确;
c、不同物质表示速率,到达平衡时,正逆速率之比等于化学计量数之比,v逆(SO2):v正(O2)=2:1,v逆(SO2)=2v正(O2),故c正确;
d、根据质量守恒,化学反应前后混合物的质量不变,容器体积不变,所以密度始终不变,故d错误;
故答案为:b、c;
(5)容器的体积减小,压强增大,平衡向逆反应方向移动,SO3的物质的量增多,故答案为:c.
| C2(SO2)C(O2) |
| C2(SO3) |
| C2(SO2)C(O2) |
| C2(SO3) |
(2)根据v=
| △c |
| △t |
| ||
| △t |
| ||
| 8min |
| 1 |
| 2 |
故答案为:0.0125mol/(L?min);
(3)温度升高,反应速率增大;温度升高,化学平衡正向移动,生成物的浓度增大,反应物的浓度减少,平衡常数增大;温度升高,化学平衡正向移动,混合气体的总物质的量增大,质量不变,摩尔质量减少,即平均相对分子质量减少;故答案为:增大;增大;减小;
(4)a、表示同一方向反应速率,v(SO2)自始至终为v(O2)的2倍,不能说明达到平衡,故a错误;
b、该反应前后气体体积变化,所以压强不变,反应已达到平衡状态,故b正确;
c、不同物质表示速率,到达平衡时,正逆速率之比等于化学计量数之比,v逆(SO2):v正(O2)=2:1,v逆(SO2)=2v正(O2),故c正确;
d、根据质量守恒,化学反应前后混合物的质量不变,容器体积不变,所以密度始终不变,故d错误;
故答案为:b、c;
(5)容器的体积减小,压强增大,平衡向逆反应方向移动,SO3的物质的量增多,故答案为:c.
点评:本题主要考查平衡常数、反应速率、平衡平衡状态的判断及读图表能力,难度中等,判断平衡时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
 某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示.下列说法在不正确的是( )
某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示.下列说法在不正确的是( )