题目内容
| 物质 | NaCl | MgCl2 | AlCl3 | SiCl4 |
| 沸点/℃ | 1465 | 1412 | 181(升华) | 57.6 |
②以上四种物质中,属于共价化合物的是 。
③若你得到的规律具有普遍性,则以下两种物质的沸点高低是:LiCl BCl3(填“>”、“==”、“<”)。
(2)在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:
CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。
回答下列问题:
①平衡时CO的转化率为 ,该反应的化学平衡常数为 。
②如果继续向该平衡体系中通入1.0mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率将 (填“增大”、“减小”、“不变”),预计CO的转化率为 。
③427℃时该反应的平衡常数为9.4,请结合①中的计算结果判断该反应的△H 0(填“>”、“==”、“<”)。
(1)①第三周期元素的氯化物,自钠到硅,键型由离子化合物过渡到共价化合物,沸点显著地降低。(2分) ②SiCl4、AlCl3(2分) ③﹥(1分)
(2)①50%(1分),1(1分)②增大(1分),66.7%(或0.667)(2分)③﹤(1分)
(2)①50%(1分),1(1分)②增大(1分),66.7%(或0.667)(2分)③﹤(1分)
(1)①从表中数据可以看出它们的沸点依次降低,且前面两种物质的沸点远高于后面两种,由晶体结构的有关知识可知,它们应属于不同的晶体类型,前两个为典型的金属与典型的非金属形成的化合物,应为离子化合物,属于离子晶体,所以沸点较高;后两者沸点很低只能是属于分子晶体,是共价化合物;所以可得出的规律是:第三周期元素的氯化物,自钠到硅,键型由离子化合物过渡到共价化合物,沸点显著地降低。②由前面分析可知为SiCl4、AlCl3共价化合物;③从上面的规律可知排在周期表左边的氯化物的沸点比在右边的要高,而Li在B的左边,故LiCl >BCl3;
(2)① CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
开始: 1 1 0 0
转化: 0.5 0.5 0.5 0.5
平衡: 0.5 0.5 0.5 0.5
平衡时CO的转化率为:50%,又因为平衡时各物质的浓度相等,故平衡常数为1。
②增大一种反应物的浓度可以提高其它反应物的转化率而自己本身的转化率要降低,故如果继续向该平衡体系中通入1.0mol的水,CO的转化率将增大。
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
开始: 1 2 0 0
转化: n n n n
平衡: 1—n 2—n n n
K=n×n/(1—n)(2—n)="1 " 所以n="2/3 " 故CO的转化率为66.7%
③由800℃变到427℃,平衡常数由1增大到9.4,故降温平衡向正反应方向移动,
所以△H<0.
(2)① CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)开始: 1 1 0 0
转化: 0.5 0.5 0.5 0.5
平衡: 0.5 0.5 0.5 0.5
平衡时CO的转化率为:50%,又因为平衡时各物质的浓度相等,故平衡常数为1。
②增大一种反应物的浓度可以提高其它反应物的转化率而自己本身的转化率要降低,故如果继续向该平衡体系中通入1.0mol的水,CO的转化率将增大。
CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)开始: 1 2 0 0
转化: n n n n
平衡: 1—n 2—n n n
K=n×n/(1—n)(2—n)="1 " 所以n="2/3 " 故CO的转化率为66.7%
③由800℃变到427℃,平衡常数由1增大到9.4,故降温平衡向正反应方向移动,
所以△H<0.

练习册系列答案
相关题目
 C(g)在密闭容器中进行。A的含量和温度
C(g)在密闭容器中进行。A的含量和温度
 2SO3(g)。现取3 L SO2和6 L O2混合,当反应达到平衡后,测得混合气体的体积减小10%。
2SO3(g)。现取3 L SO2和6 L O2混合,当反应达到平衡后,测得混合气体的体积减小10%。 xC(g)+4D(g),若按下列两种配比在同温同体积的密闭容器中进行反应:
xC(g)+4D(g),若按下列两种配比在同温同体积的密闭容器中进行反应: Si3N4 + 6CO,有关说法不正确的是 ( )
Si3N4 + 6CO,有关说法不正确的是 ( )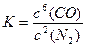
 2Z(g);△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是
2Z(g);△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是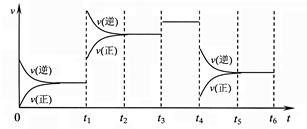
 CO(g)+3H2(g);△H1=+216kJ/mol;CH4(g)+ CO2(g)
CO(g)+3H2(g);△H1=+216kJ/mol;CH4(g)+ CO2(g)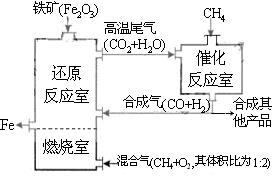
 C(气)+D(气)
C(气)+D(气)