题目内容
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。
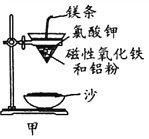
(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。指明使用镁条和氯酸钾的目的是 ______________________。
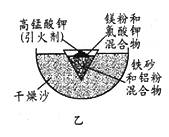
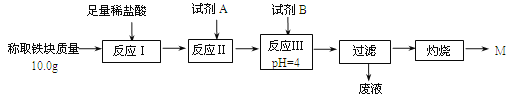
(2)某同学用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液未见血红色。为测定该实验所得 “铁块”中铁元素含量,设计实验流程如图所示。
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
Fe2+ | Fe3+ | Al3+ | Mg2+ | |
开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
① 试剂A应选择________,试剂B应选择_______。(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水
② 写出反应Ⅱ的离子方程式_____________________。
③ 设计简单实验证明M的成分是Fe2O3而非Fe3O4。
操作 | 预期现象 |
取少量M固体于试管中,向其中加入________________;观察。 | 固体完全溶解,溶液呈黄色。 |
继续向上述溶液中滴入_________________,振荡观察 | ______________________ |
④ 上述实验应灼烧至M质量不变,则能证明M质量不变的标志是____________。
⑤ 若最终红色粉未M的质量为12.0 g,则该“铁块”的纯度是_______。
【答案】引发铝热反应CD2Fe2+ + H2O2 + 2H+ = 2Fe3++2H2O足量稀硫酸几滴(少量)高锰酸钾溶液溶液紫红色未褪去连续两次灼烧质量相差不大于0.1g84.0%
【解析】(1)铝热反应需要在高温条件下进行,Mg条燃烧,放出热量,使氯酸钾分解产生O2,促使镁条剧烈燃烧,产生更多的热量,达到铝热反应所需要的高温。答案为:引发铝热反应
(2))①由提给信息可知,铁块中含+2价铁,根据表格可知,要使铁元素完全沉淀而铝离子和镁离子不沉淀,需将Fe2+转化为Fe3+,故需要加入H2O2;然后调节4≤pH<4.2即可将Fe3+沉淀而Al3+、Mg2+不沉淀,调节pH选用的试剂不能用氧化铁,因为会引起红色粉未M的质量偏大,故应选用氨水,故答案为:C;D
② Fe2+具有还原性,能被H2O2在酸性下氧化成Fe3+,2Fe2+ + H2O2 + 2H+ = 2Fe3++2H2O
③ Fe2O3中Fe为+3价,Fe3O4中Fe既有+3价,又有+2价,取少量M固体于试管中,向其中加入足量稀硫酸,发现固体溶解,溶液呈黄色,说明溶液中含Fe3+;再向溶液中加入KMnO4溶液,观察现象,发现溶液紫红色未褪去,说明溶液中无Fe2+,因为Fe2+有还原性,能与酸性KMnO4溶液发生氧化还原反应,而使KMnO4溶液褪色。故答案为:足量稀硫酸、几滴(少量)高锰酸钾溶液 、 溶液紫红色未褪去 ;
④ 若Fe(OH)3已完全分解,则用天平连续两次称量M的质量时相差不大于0.1g。故答案为:连续两次灼烧质量相差不大于0.1g;
⑤红色粉末为Fe2O3 ,质量为12.0g,物质的量为12/160 =0.075(mol),根据铁守恒有铁块中铁的质量为0.075*56*2=8.4(g),铁块纯度为![]() ×100℅=84℅
×100℅=84℅


