题目内容
有下列四种微粒:①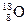 、②
、②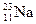 、③
、③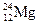 、④
、④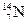 。用①、②、③、④回答:
。用①、②、③、④回答:
(1)按原子半径由大到小顺序排列的是 ,
(2) 微粒中质子数小于中子数的是 ,
微粒中质子数小于中子数的是 ,
(3)在化合物中呈现的化合价的数值最高的是 ,
(4)能形成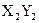 型化合物的是 。
型化合物的是 。
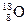 、②
、②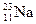 、③
、③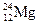 、④
、④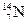 。用①、②、③、④回答:
。用①、②、③、④回答:(1)按原子半径由大到小顺序排列的是 ,
(2)
 微粒中质子数小于中子数的是 ,
微粒中质子数小于中子数的是 ,(3)在化合物中呈现的化合价的数值最高的是 ,
(4)能形成
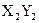 型化合物的是 。
型化合物的是 。
略

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
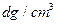 ,其摩尔质量为
,其摩尔质量为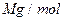 ,则该晶胞的体积是 。(请列出算式)
,则该晶胞的体积是 。(请列出算式)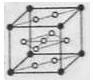
 、
、 、
、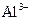 、
、 、
、 等五种离子按半径由大到小的顺序排列(用离子符号表示)____________________。
等五种离子按半径由大到小的顺序排列(用离子符号表示)____________________。 含放射性物质超标的水和食物,不会对人体产生危害
含放射性物质超标的水和食物,不会对人体产生危害 化
化