题目内容
可逆反应A(g)+3B(g)A.甲中反应达到平衡时,Q1=Q
B.达到平衡时,甲中C的体积分数比乙大
C.达到平衡后,再向乙中加入0.25 mol A、0.75 mol B、1.5 mol C,平衡向生成C的方向移动
D.乙中的热化学反应方程式为![]() A(g)+3B(g) ΔH=+Q2 kJ·mol-1
A(g)+3B(g) ΔH=+Q2 kJ·mol-1
C 由于反应是可逆的,故A错 。甲、乙是等效平衡,B错。C项相当于增大压强,平衡正向移动,故正确。D项中ΔH应为+Q kJ·mol-1。

练习册系列答案
相关题目
在一定条件下,对于密闭容器中进行的可逆反应A(g)+3B(g)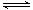
|
A.A、B、C的分子数之比为1∶3∶2
B.A、B、C的浓度相等
C.单位时间生成 n mol A,同时生成 3n mol B
D.生成C的速率与C分解的速率相等
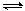
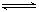 2C(g)达到平衡状态的标志是
2C(g)达到平衡状态的标志是 nC(g)
(正反应放热)生成物C的浓度随压强变化并建立平衡的关系图,则n值与压强P1、P2的关系正确的是
nC(g)
(正反应放热)生成物C的浓度随压强变化并建立平衡的关系图,则n值与压强P1、P2的关系正确的是