题目内容
【题目】连二亚硫酸钠(Na2S2O4),也称为保险粉,Na2S2O4易溶于水,难溶于乙醇,具有极强的还原性,易被空气氧化,在碱性介质中稳定。其阴离子的结构如图所示: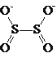 。某科研小组制备并探究其性质。
。某科研小组制备并探究其性质。
Ⅰ.制备Na2S2O4(加热等辅助仪器略去)

(1)Na2S2O4中硫元素的化合价为_______。
(2)连接好装置后,检查其气密性良好的操作是____________________。
(3)添加药品、再次连接好装置:
①第一步,将A中生成的气体通往B中进行反应,在B装置生成连二亚硫酸锌的化合反应方程式为__________;
②第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,该步反应的离子方程式为_____________。
第三步,将第二步的混合物过滤,并向滤液中加入固体NaCl,冷却至20℃,便有Na2S2O4晶体析出。
③第四步,将第三步所得混合物经________(填操作名称)、________(填写 “水”或“乙醇”)洗涤,得到纯净的Na2S2O4晶体。
(4)装置C的作用是 _______________。
Ⅱ.探究Na2S2O4的稳定性
(5)隔绝空气加热Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3和SO2,但科研小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。请设计实验证明该分解产物中含有Na2SO4。实验方案是______________。(可选试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液、KMnO4溶液)
【答案】+3 关闭分液漏斗的旋塞,将C装置的导管插入烧杯中的水面下,微热烧瓶,导管口有气泡产生,停止加热,导管口形成一段水柱,则气密性良好 2SO2 + Zn = ZnS2O4 Zn2+ + 2OH- ![]() Zn(OH)2↓ 过滤 乙醇 吸收SO2,防止污染空气;隔离空气,防止空气中的O2将产物氧化 取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质
Zn(OH)2↓ 过滤 乙醇 吸收SO2,防止污染空气;隔离空气,防止空气中的O2将产物氧化 取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质
【解析】
⑴根据化合价分析,钠为+1价,O为-2价,Na2S2O4中硫元素的化合价为+3价,故答案为+3;
⑵连接好装置后,检查其气密性良好的操作是关闭分液漏斗的旋塞,将C装置的导管插入烧杯中的水面下,微热烧瓶,导管口有气泡产生,停止加热,导管口形成一段水柱,则气密性良好,故答案为关闭分液漏斗的旋塞,将C装置的导管插入烧杯中的水面下,微热烧瓶,导管口有气泡产生,停止加热,导管口形成一段水柱,则气密性良好;
⑶添加药品、再次连接好装置:
①第一步,将A中生成的气体通往B中进行反应,在B装置生成连二亚硫酸锌的化合反应方程式为2SO2 + Zn = ZnS2O4,故答案为2SO2 + Zn = ZnS2O4;
②第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,主要是发生复分解反应生成沉淀,该步反应的离子方程式为Zn2+ + 2OH- ![]() Zn(OH)2↓,
Zn(OH)2↓,
故答案为Zn2+ + 2OH- ![]() Zn(OH)2↓;
Zn(OH)2↓;
第三步,将第二步的混合物过滤,并向滤液中加入固体NaCl,冷却至20℃,便有Na2S2O4晶体析出。
③第四步,由于有Na2S2O4晶体析出,因此将第三步所得混合物经过滤、由于Na2S2O4易溶于水,不能用水洗涤,只能用乙醇洗涤,得到纯净的Na2S2O4晶体,故答案为过滤;乙醇;
⑷由于反应中二氧化硫不能完全反应,因此装置C的作用是吸收SO2,防止污染空气;隔离空气,防止空气中的O2将产物氧化,故答案为吸收SO2,防止污染空气;隔离空气,防止空气中的O2将产物氧化;
⑸隔绝空气加热Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3和SO2,但科研小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。请设计实验证明该分解产物中含有Na2SO4。要将亚硫酸钠溶液全部与盐酸反应,将得到的溶液再加入氯化钡反应,实验方案是取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质,故答案为取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质。

 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案