题目内容
向Na2S2O3和Na2S的混合溶液中缓慢滴入足量的稀H2SO4。完全反应后,得到3.20g沉淀和336mL气体(标准状况),溶液总体积为100mL,溶液中H2S的浓度为0.100mol·L-1。
(1)写出各反应的化学方程式。
(2)336mL气体是什么气体?为什么?
(3)求原混合溶液中Na2S2O3和Na2S的物质的量。
答案:
解析:
解析:
(1)Na2S2O3+H2SO4
|

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
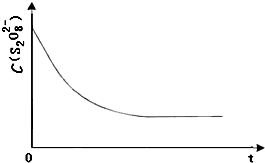 碘在科研与生活中有重要应用.某兴趣小组用0.50mol?L-1KI、0.2%淀粉溶液、0.20mol?L-1K2S2O8、0.10mol?L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用.某兴趣小组用0.50mol?L-1KI、0.2%淀粉溶液、0.20mol?L-1K2S2O8、0.10mol?L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.