��Ŀ����
����Ŀ����.A��һ�ֳ������ʣ�A��B��C��D֮���ת����ϵ��ͼ��C��һ�����������ʡ�
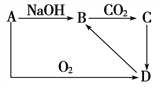
��1����A��һ�ֽ�������A��________����д����A��B �����ӷ���ʽ_________________________
��2����A��һ�ַǽ�������A��________��
��д����B��C �����ӷ���ʽ_______________________
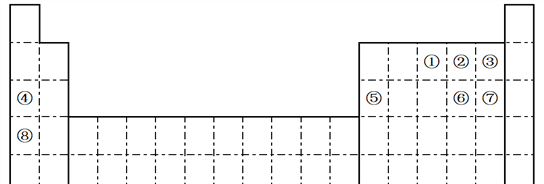
��.ijͬѧ�ڻ�ij��Ԫ�ص�һ�ֵ������Ľṹʾ��ͼʱ��������ԲȦ�ڱ��������������������������ʾ�����Լ����жϡ�
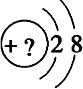
��1������������������������Ԫ�ط�����____________
��2�������Ļ�ԭ�Ժ�����ʧȥ1�����Ӻ��Ϊԭ�ӣ�ԭ�ӵ������Ժ�ǿ���õ�����ˮ��Ӧ�Ļ�ѧ����ʽ________________________________________
��3�������������Ժ������õ�1�����Ӻ��Ϊԭ�ӣ�ԭ�ӵĻ�ԭ�Ժ�ǿ���õ���������ȼ�����ò���ĵ���ʽ______________
��4�������Ļ�ԭ�Ժ�����ʧȥ2�����Ӻ���ԭ�ӣ����⻯��Ľṹʽ______________
��5�������ķ���ΪX3+��������������ǿ�Ӧ�����ӷ���ʽ____________________________
���𰸡� Al 2 Al +2 OH��+ 2H2O===2AlO2�� + 3H2�� Si SiO32��+ H2O +CO2===H2SiO3��+CO32�� Ne 2F2 + 2H2O===4HF + O2 ![]() H��O��H��H��O��O��H Al(OH)3 + OH��===AlO2�� + 2H2O
H��O��H��H��O��O��H Al(OH)3 + OH��===AlO2�� + 2H2O
��������I. �ӿ�ͼ���Կ�����D��һ�������B��һ�����Σ�C��һ�����������ʣ�ͨ��CO2�ܲ���������������Ҫ��ƫ�����κ����Σ��ʿɳ����ƶ�A������Si��Al��
(1). ��A��һ�ֽ�������A��Al��BΪNaAlO2��A��B�����ӷ���ʽΪ2Al+2H2O+2OH��=2AlO2��+3H2�����ʴ�Ϊ��Al��2Al+2H2O+2OH��=2AlO2��+3H2����
(2). ��A��һ�ַǽ�������A��Si��BΪNa2SiO3��CΪH2SiO3��B��C�����ӷ���ʽΪSiO32��+ H2O +CO2===H2SiO3��+CO32�����ʴ�Ϊ��Si��SiO32��+ H2O +CO2===H2SiO3��+CO32����
II. (1). �ɸõ������Ľṹʾ��ͼ��֪����ԭ�Ӻ�����10�����ӣ�������������������������=�����������֪����������NeԪ�أ��ʴ�Ϊ��Ne��
(2). �����Ļ�ԭ�Ժ�����ʧȥ1�����Ӻ��Ϊԭ�ӣ�˵����Ԫ�ص�ԭ�Ӻ���9�����ӣ�ΪFԪ�أ�F2��ˮ��Ӧ����HF��O2����ѧ����ʽΪ��2F2 + 2H2O=4HF + O2���ʴ�Ϊ��2F2 + 2H2O=4HF + O2��
(3). �����������Ժ������õ�1�����Ӻ��Ϊԭ�ӣ�˵����Ԫ�ص�ԭ�Ӻ���11�����ӣ�ΪNaԪ�أ�Na��������ȼ������Na2O2��Na2O2�ĵ���ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(4). �����Ļ�ԭ�Ժ�����ʧȥ2�����Ӻ���ԭ�ӣ�˵����Ԫ�ص�ԭ�Ӻ���8�����ӣ�ΪOԪ�أ�OԪ�ص��⻯����H2O��H2O2���ṹʽΪ��H��O��H��H��O��O��H���ʴ�Ϊ��H��O��H��H��O��O��H��
(5). �����ķ���ΪX3+��˵����Al3+��Al(OH)3��ǿ�Ӧ����ƫ�����κ�ˮ�����ӷ���ʽΪ��Al(OH)3 + OH��=AlO2�� + 2H2O���ʴ�Ϊ��Al(OH)3 + OH��=AlO2�� + 2H2O��

 Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д� Ŀ�����ϵ�д�
Ŀ�����ϵ�д�