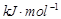题目内容
化工生产中常用的CO和H2,可通过烃与水蒸气反应得到。其中甲烷可发生以下两个反应:
①CH4(g)+1/2O2(g)== =2H2(g)+CO(g) ΔH=-36 kJ/mol
②CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+216 kJ/mol
下列热化学方程式中,反应热为零的是
①CH4(g)+1/2O2(g)== =2H2(g)+CO(g) ΔH=-36 kJ/mol
②CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+216 kJ/mol
下列热化学方程式中,反应热为零的是
| A.4CH4(g)+O2(g)+2H2O(g)===4CO(g)+10H2(g) |
| B.7CH4(g)+3O2(g)+H2O(g)==="7CO" (g)+15H2(g) |
| C.3CH4(g)+O2(g)+H2O(g)===3CO(g)+7H2(g) |
| D.5CH4(g)+2O2(g)+H2O(g)===5CO(g)+11H2(g) |
B
由盖斯定律可求得四个选项的反应热依次为:+360 kJ/mol、0、+144 kJ/mol、+72kJ/mol

练习册系列答案
相关题目