题目内容
食盐是日常生活的必需品,也是重要的化工原料.
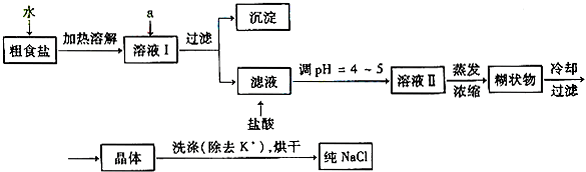
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
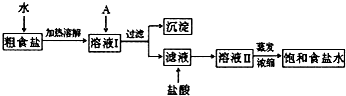
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出A所代表的试剂,按滴加顺序依次为______(只填化学式).
②加盐酸的目的是(用离子方程式表示)______.
(2)某化学小组拟采用如下装置(夹持和加热仪器已略去)电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时验证氯气的氧化性.
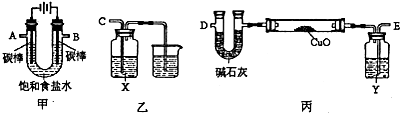
①写出甲中反应的化学方程式______.
②为完成上述实验,正确的连接顺序为A连______,B连______(填接口字母).
③乙装置中X试剂可以是______,丙装置中Y试剂的作用是______.
④测定Cu的相对原子质量.
将ω g CuO置于硬质玻璃管中,按以下两个方案测得的数据计算Cu的相对原子质量.
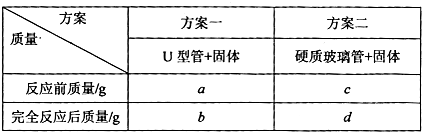
请回答:
你认为方案______较佳,另一个方案得到的Cu的相对原子质量会______填“偏低”、“偏高”).按较佳方案计算,得到Cu的相对原子质量是______.
解:(1)①加入过量的氢氧化钠可以除去镁离子和铁离子,加入适量的盐酸可以除去反应剩余的氢氧化钠和碳酸钠,加入适量的碳酸钠可以除去钙离子和反应剩余的氯化钡,加入氯化钡可以除去硫酸根离子,欲除去Ca2+、Mg2+、Fe3+、SO42-离子,先加入过量BaCl2溶液,与SO42-发生反应,生成BaSO4沉淀;再加过量NaOH溶液,与Mg2+和Fe3+发生反应,生成Mg(OH)2沉淀、Fe(OH)3沉淀,最后加入过量Na2CO3溶液,与Ca2+发生反应,生成CaCO3沉淀,与过量BaCl2的反应生成生成BaCO3沉淀;所以滴加的顺序为:BaCl2溶液,NaOH溶液,Na2CO3溶液;
②加适量盐酸,与①中过量NaOH溶液和过量Na2CO3溶液发生反应,生成氯化钠、水和二氧化碳气体,离子方程式为:H++OH-═H2O,CO32-+2H+═H2O+CO2↑;
(1)①在食盐水里氯化钠完全电离,水分子是微弱电离的,因而存在着Na+、H+、Cl-、OH-四种离子.
当接通直流电原后,带负电的OH-和Cl-移向阳极,带正电的Na+和H+移向阴极.
在这样的电解条件下,
在阳极,Cl-比OH-容易失去电子被氧化成氯原子,氯原子两两结合成氯分子放出.
2Cl--2e-=Cl2↑(氧化反应),
在阴极,H+比Na+容易得到电子,因而H+不断从阴极获得电子被还原为氢原子,氢原子两两结合成氢分子从阴极放出.
2H++2e-=H2↑ (还原反应),
由于H+在阴极上不断得到电子而生成氢气放出,破坏了附近的水的电离平衡,水分子继续电离成H+和OH-,H+又不断得到电子,结果溶液里OH-的数目相对地增多了,因而阴极附近形成了氢氧化钠的溶液.电解饱和食盐水的总的化学方程式可以表示如下:2NaCl+2H2O 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
②A为阴极,产生的氢气中含有水蒸气,通入Y试剂中进行干燥,再通入CuO粉末来测定Cu的相对原子质量,减少误差;B为阳极,产生的氯气通入X试剂中验证氯气的氧化性;所以A连E,B连C;
③试剂X为了验证氯气的氧化性,可选择具有还原性的物质,且反应现象明显,可选择淀粉碘化钾溶液,通入氯气,溶液由无色变为蓝色,说明氯气与碘化钾反应生成碘,氯气为氧化剂,表现氧化性;电解饱和食盐水产生的氢气中含有水蒸气,会影响铜的相对原子质量的测定,需进行干燥,丙装置中Y试剂是为了吸收氢气中的水;
④如选方案一数据进行计算时,主要考虑两方面原因会导致测定Cu的相对原子质量偏大或偏小,U形管中的干燥剂也可能吸收空气中的水和CO2,导致测定结果偏大,得到Cu的相对原子质量偏低;
根据质量守恒定律和题给氧化铜质量及方案二所测数据,
设Cu的相对原子质量为x,由反应前后氧元素的质量是不变的,
得等式为: =c-d
=c-d
解得:x=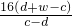
所以按较佳方案计算,得到Cu的相对原子质量是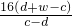 .
.
故答案为:(1)①BaCl2、NaOH、Na2CO3;
②H++OH-═H2O,CO32-+2H+═H2O+CO2↑;
(2)①2NaCl+2H2O 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
②E,C;
③淀粉KI溶液,吸收氢气中的水;
④二,偏低,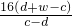 .
.
分析:(1)根据镁离子和铁离子会与氢氧根离子和碳酸根离子生成沉淀,钙离子会与碳酸根离子生成沉淀,硫酸根离子会与钡离子生成沉淀,加入盐酸可以除去过量的碳酸钠和氢氧化钠等进行分析;
(2)①电解饱和食盐水,Cl-在阳极失电子产生氯气,H+在阴极得电子产生氢气,H+不断得到电子,结果溶液里OH-的数目相对地增多了,因而阴极附近形成了氢氧化钠的溶液.电解饱和食盐水的总的化学方程式可以表示如下:2NaCl+2H2O 2NaOH+H2+Cl2↑;
2NaOH+H2+Cl2↑;
②A为阴极,产生的氢气通入E试剂中干燥,再通入CuO粉末来测定Cu的相对原子质量;B为阳极,产生的氯气通入X试剂验证氯气的氧化性;
③试剂X为了验证氯气的氧化性,可选择具有还原性的物质,且反应现象明显;丙装置中Y试剂是为了吸收氢气中的水,减少误差;
④选方案一的数据进行计算时,主要考虑U型管也可能吸收空气中的CO2或澄清石灰水也可能未吸收完生成的CO2两方面原因会导致测定Cu的相对原子质量偏大或偏小;
选用了方案二数据进行计算是利用反应前后CuO中氧元素的减少量和实验前准确称取CuO的质量为wg中氧元素的质量相等,求得Cu的相对原子质量.
点评:除杂时,注意除杂的最后不能再有其他杂质,过滤要放在所有沉淀步骤的最后;利用实验测定数据进行计算,要排出诸多影响测定结果的干扰,此题真能锻炼学生应用所学知识及慎密思维的能力.
②加适量盐酸,与①中过量NaOH溶液和过量Na2CO3溶液发生反应,生成氯化钠、水和二氧化碳气体,离子方程式为:H++OH-═H2O,CO32-+2H+═H2O+CO2↑;
(1)①在食盐水里氯化钠完全电离,水分子是微弱电离的,因而存在着Na+、H+、Cl-、OH-四种离子.
当接通直流电原后,带负电的OH-和Cl-移向阳极,带正电的Na+和H+移向阴极.
在这样的电解条件下,
在阳极,Cl-比OH-容易失去电子被氧化成氯原子,氯原子两两结合成氯分子放出.
2Cl--2e-=Cl2↑(氧化反应),
在阴极,H+比Na+容易得到电子,因而H+不断从阴极获得电子被还原为氢原子,氢原子两两结合成氢分子从阴极放出.
2H++2e-=H2↑ (还原反应),
由于H+在阴极上不断得到电子而生成氢气放出,破坏了附近的水的电离平衡,水分子继续电离成H+和OH-,H+又不断得到电子,结果溶液里OH-的数目相对地增多了,因而阴极附近形成了氢氧化钠的溶液.电解饱和食盐水的总的化学方程式可以表示如下:2NaCl+2H2O
 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;②A为阴极,产生的氢气中含有水蒸气,通入Y试剂中进行干燥,再通入CuO粉末来测定Cu的相对原子质量,减少误差;B为阳极,产生的氯气通入X试剂中验证氯气的氧化性;所以A连E,B连C;
③试剂X为了验证氯气的氧化性,可选择具有还原性的物质,且反应现象明显,可选择淀粉碘化钾溶液,通入氯气,溶液由无色变为蓝色,说明氯气与碘化钾反应生成碘,氯气为氧化剂,表现氧化性;电解饱和食盐水产生的氢气中含有水蒸气,会影响铜的相对原子质量的测定,需进行干燥,丙装置中Y试剂是为了吸收氢气中的水;
④如选方案一数据进行计算时,主要考虑两方面原因会导致测定Cu的相对原子质量偏大或偏小,U形管中的干燥剂也可能吸收空气中的水和CO2,导致测定结果偏大,得到Cu的相对原子质量偏低;
根据质量守恒定律和题给氧化铜质量及方案二所测数据,
设Cu的相对原子质量为x,由反应前后氧元素的质量是不变的,
得等式为:
 =c-d
=c-d解得:x=
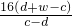
所以按较佳方案计算,得到Cu的相对原子质量是
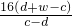 .
.故答案为:(1)①BaCl2、NaOH、Na2CO3;
②H++OH-═H2O,CO32-+2H+═H2O+CO2↑;
(2)①2NaCl+2H2O
 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;②E,C;
③淀粉KI溶液,吸收氢气中的水;
④二,偏低,
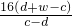 .
.分析:(1)根据镁离子和铁离子会与氢氧根离子和碳酸根离子生成沉淀,钙离子会与碳酸根离子生成沉淀,硫酸根离子会与钡离子生成沉淀,加入盐酸可以除去过量的碳酸钠和氢氧化钠等进行分析;
(2)①电解饱和食盐水,Cl-在阳极失电子产生氯气,H+在阴极得电子产生氢气,H+不断得到电子,结果溶液里OH-的数目相对地增多了,因而阴极附近形成了氢氧化钠的溶液.电解饱和食盐水的总的化学方程式可以表示如下:2NaCl+2H2O
 2NaOH+H2+Cl2↑;
2NaOH+H2+Cl2↑;②A为阴极,产生的氢气通入E试剂中干燥,再通入CuO粉末来测定Cu的相对原子质量;B为阳极,产生的氯气通入X试剂验证氯气的氧化性;
③试剂X为了验证氯气的氧化性,可选择具有还原性的物质,且反应现象明显;丙装置中Y试剂是为了吸收氢气中的水,减少误差;
④选方案一的数据进行计算时,主要考虑U型管也可能吸收空气中的CO2或澄清石灰水也可能未吸收完生成的CO2两方面原因会导致测定Cu的相对原子质量偏大或偏小;
选用了方案二数据进行计算是利用反应前后CuO中氧元素的减少量和实验前准确称取CuO的质量为wg中氧元素的质量相等,求得Cu的相对原子质量.
点评:除杂时,注意除杂的最后不能再有其他杂质,过滤要放在所有沉淀步骤的最后;利用实验测定数据进行计算,要排出诸多影响测定结果的干扰,此题真能锻炼学生应用所学知识及慎密思维的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目