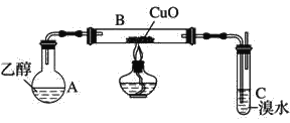
ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩ―«œθθΘΝρΥαΘ®NOSO4HΘ©¥ΩΤΖΈΣάβ–ΈΫαΨßΘ§»ή”ΎΝρΥαΘ§”ωΥ°“ΉΖ÷ΫβΘ§≥Θ”Ο”Ύ÷Τ»ΨΝœΓΘ÷Τ±ΗNOSO4HΒΡΖ¥”Π‘≠άμΈΣΘΚ![]() ΓΔ
ΓΔ![]() ΓΘ
ΓΘ
Θ®1Θ©―«œθθΘΝρΥαΘ®NOSO4HΘ©ΒΡ÷Τ±ΗΓΘ
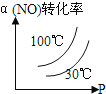
ΔΌ“«ΤςΔώΒΡΟϊ≥ΤΈΣ_________ΓΘ
ΔΎΑ¥ΤχΝς¥”ΉσΒΫ”“ΒΡΥ≥–ρΘ§…œ ω“«ΤςΒΡΝ§Ϋ”Υ≥–ρΈΣ____Θ®Χν“«ΤςΫ”ΩΎΉ÷ΡΗΘ§≤ΩΖ÷“«ΤςΩ…÷ΊΗ¥ Ι”ΟΘ©ΓΘ
ΔέΈΣΝΥΩΊ÷ΤB÷–Ά®»κSO2ΒΡΥΌ¬ Θ§Ω…“‘≤…»ΓΒΡ¥κ © «_____ΓΘ
ΔήNOSO4H”ωΥ°Ζ÷ΫβΒΡΜ·―ßΖΫ≥Χ ΫΈΣ______Θ§»τ»ΞΒτΉΑ÷ΟCΜα ΙNOSO4HΒΡ≤ζΝΩ____Θ®ΧνΓΑ‘ω¥σΓ±ΓΔΓΑΦθ…ΌΓ±ΜρΓΑΈό”ΑœλΓ±Θ©ΓΘ
Θ®2Θ©―«œθθΘΝρΥαΘ®NOSO4HΘ©¥ΩΕ»ΒΡ≤βΕ®ΓΘ
ΉΦ»Ζ≥Τ»Γ1.337g≤ζΤΖΦ”»κ250mLΒβΝΩΤΩ÷–Θ§Φ”»κ60.00mL≈®Ε»ΈΣ0.1000molΓΛLΘ≠1KMnO4±ξΉΦ»ή“ΚΚΆ10mL25%H2SO4»ή“ΚΘ§»ΜΚσ“Γ‘»ΓΘ”Ο0.2500molΓΛLΘ≠1Na2C2O4±ξΉΦ»ή“ΚΒΈΕ®Θ§œϊΚΡNa2C2O4»ή“ΚΒΡΧεΜΐ20.00mLΓΘ
ΦΚ÷ΣΘΚΔΓ. ![]() + NOSO4H+
+ NOSO4H+ ![]() ΓΔ +
ΓΔ + ![]() +
+ ![]() +
+ ![]()
ΔΔ.![]()
ΔΌΆξ≥…Ζ¥”ΠΔΓΒΡάκΉ”ΖΫ≥Χ ΫΘΚ
____![]() +____
+____![]() ____
____![]() ____+____
____+____![]() +____
+____![]() +____
+____![]()
ΔΎΒΈΕ®÷’ΒψΒΡœ÷œσΈΣ________ΓΘ
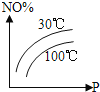
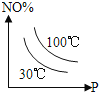
Δέ≤ζΤΖΒΡ¥ΩΕ»ΈΣ_____%Θ®±ΘΝτΝΫΈΜ”––ß ΐΉ÷Θ©ΓΘ
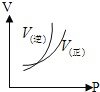
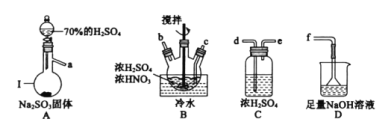
ΓΨ¥πΑΗΓΩ’τΝσ…’ΤΩ aΓζdeΓζcbΓζdeΓζf ΒςΫΎΉΑ÷ΟA÷–ΒΡΖ÷“Κ¬©ΕΖΜν»ϊΘ§ΩΊ÷ΤΝρΥα»ή“ΚΒΡΒΈΦ”ΥΌΕ» ![]() Θ®ΤδΥϊΚœάμ¥πΑΗΨυΗχΖ÷Θ© Φθ…Ό 2 5 2
Θ®ΤδΥϊΚœάμ¥πΑΗΨυΗχΖ÷Θ© Φθ…Ό 2 5 2 ![]() 5 5 9 ΒΈ»κΉνΚσ“ΜΒΈ
5 5 9 ΒΈ»κΉνΚσ“ΜΒΈ![]() »ή“ΚΚσΘ§»ή“Κ”…«≥Ήœ…Ϊ±δΈΣΈό…Ϊ«“ΑκΖ÷÷”―’…Ϊ≤ΜΜ÷Η¥ 95
»ή“ΚΚσΘ§»ή“Κ”…«≥Ήœ…Ϊ±δΈΣΈό…Ϊ«“ΑκΖ÷÷”―’…Ϊ≤ΜΜ÷Η¥ 95
ΓΨΫβΈωΓΩ
NOSO4H”ωΥ°“ΉΥ°ΫβΘ§“ρ¥Υ‘Ύ÷Τ±ΗΙΐ≥Χ÷–Θ§“ΣΖά÷ΙΥ°Ϋχ»κΖΔ…ζΉΑ÷ΟΓΘάϊ”Ο70%H2SO4ΚΆNa2SO3÷Τ±ΗSO2Θ§SO2÷–Κ§”–Υ°’τΤχΘ§–η“Σ≥ΐ»ΞΘ§άϊ”Ο≈®ΝρΥα≥ΐ»ΞΥ°Ζ÷ΘΜ‘ΎB÷–ΖΔ…ζΖ¥”ΠΘ§άϊ”ΟDΉΑ÷Ο¥ΠάμΈ¥Ζ¥”ΠΒΡSO2Θ§ΈΣΝΥΖά÷ΙD÷–ΒΡΥ°’τΤχΆ®Ιΐ¬©ΕΖΫχ»κΉΑ÷ΟBΘ§BΚΆD÷°Φδ–η“Σ”ΟΉΑ÷ΟCΖά÷ΙΥ°Ϋχ»κBΓΘ
(1)ΔΌΗυΨίΉΑ÷ΟΒΡΧΊΒψΘ§“«ΤςΔώΒΡΟϊ≥ΤΈΣ’τΝσ…’ΤΩΘΜ
ΔΎNOSO4H”ωΥ°“ΉΥ°ΫβΘ§“ρ¥Υ‘Ύ÷Τ±ΗΙΐ≥Χ÷–Θ§“ΣΖά÷ΙΥ°Ϋχ»κΖΔ…ζΉΑ÷ΟΓΘΉΑ÷ΟA”Ο”Ύ÷Τ±ΗSO2Θ§ΉΑ÷ΟB”Ο”Ύ÷Τ±ΗNOSO4HΘ§ΉΑ÷ΟD”Ο”ΎΈ≤ΤχΈϋ ’Θ§ΈΣΝΥΖά÷ΙΥ°Ϋχ»κΉΑ÷ΟBΘ§AAΓΔB÷°ΦδΘ§BΚΆD÷°Φδ–η“ΣΦ”»κΉΑ÷ΟCΘ§“ρ¥ΥΝ§Ϋ”Υ≥–ρΈΣaΓζdeΓζcbΓζdeΓζfΘΜ
ΔέΈΣΝΥΩΊ÷ΤΆ®»κSO2ΒΡΥΌ¬ Θ§ΉΑ÷ΟA”Ο”Ύ÷Τ±ΗSO2Θ§Ω…“‘Ά®ΙΐΒςΫΎΉΑ÷ΟA÷–Ζ÷“Κ¬©ΕΖΘ§ά¥ΒςΫΎΝρΥα»ή“ΚΒΡΒΈΦ”ΥΌΕ»Θ§¥”ΕχΩΊ÷ΤΆ®»κSO2ΒΡΥΌ¬ ΘΜ
ΔήNOSO4H”κΥ°Ζ¥”Π…ζ≥…HNO2ΚΆH2SO4Θ§Μ·―ßΖΫ≥Χ ΫΈΣNOSO4HΘΪH2O=H2SO4ΘΪHNO2ΘΜ»γΙϊ»ΞΒτΉΑ÷ΟCΘ§≤ζΈοΨΆΜα”κΫχ»κΉΑ÷ΟB÷–ΒΡΥ°Ζ¥”ΠΘ§Μα «ΒΡ≤ζΈοΒΡΝΩΦθ…ΌΘΜ
(2)ΔΌ‘ΎΥα–‘ΧθΦΰœ¥Θ§MnO4Θ≠÷–MnΒΡΜ·ΚœΦέΫΒΒΆΘ§…ζ≥…Mn2ΘΪΘ§Μ·ΚœΦέΫΒΒΆ5ΦέΘΜNOSO4H÷–Θ§SΒΡΜ·ΚœΦέΈΣΘΪ6Θ§OΒΡΜ·ΚœΦέΘ≠2Θ§HΒΡΜ·ΚœΦέΘΪ1Θ§‘ρNΒΡΜ·ΚœΦέΈΣΘΪ3Θ§NΒΡΜ·ΚœΦέ¥”ΘΪ3…ΐΗΏΒΫΘΪ5Θ§Μ·ΚœΦέ…ΐΗΏ2ΘΜΗυΨίΜ·ΚœΦέ…ΐΫΒ ΊΚψΘ§‘ρMnO4Θ≠ΚΆNOSO4HΒΡΜ·―ßΦΤΝΩ ΐ÷°±»ΈΣ2ΘΚ5Θ§‘ΌΗυΨίΒγΚ… ΊΚψΚΆΈοΝœ ΊΚψΘ§Ω…ΒΟΜ·―ßΖΫ≥Χ ΫΈΣ2MnO4Θ≠ΘΪ5NOSO4HΘΪ2H2O=2Mn2ΘΪΘΪ5NO3Θ≠ΘΪ5SO42Θ≠ΘΪ9HΘΪΘΜ
ΔΎΚ§”–MnO4Θ≠ΒΡ»ή“Κ±Ψ…μΨΏ”–―’…ΪΘ§ΈΣΉœ…ΪΘΜΗ’ΩΣ ΦΘ§KMnO4 «ΙΐΝΩΒΡΘ§»ή“ΚΒΡ―’…ΪΈΣΉœ…ΪΘ§Φ”»κNa2C2O4»ή“ΚΒΈΕ®ΙΐΝΩΒΡKMnO4Θ§»ή“ΚΜα¥”Ήœ…Ϊ±δΈΣΈό…ΪΘ§“ρ¥ΥΒΈΕ®÷’ΒψΒΡœ÷œσΈΣΒΈ»κΉνΚσ“ΜΒΈNa2C2O4»ή“ΚΚσΘ§»ή“Κ”…«≥Ήœ…Ϊ±δΈΣΈό…Ϊ«“ΑκΖ÷÷”―’…Ϊ≤ΜΜ÷Η¥ΘΜ
ΔέΗυΨίΧβ“βΘ§KMnO4―θΜ·ΝΥNOSO4HΚΆNa2C2O4Θ§‘ρ”ΟΉήΒΡKMnO4Φθ»Ξ―θΜ·Na2C2O4ΒΡKMnO4Θ§Ω…«σΒΟ―θΜ·NOSO4HΒΡKMnO4Θ§¥”Εχ«σΒΟNOSO4HΒΡ÷ ΝΩΓΘΗυΨίΜ·―ßΖΫ≥Χ ΫΘ§Ω…ΒΟΙΊœΒ Ϋ2KMnO4ΓΪ5Na2C2O5Θ§‘ρ―θΜ·Na2C2O4ΒΡKMnO4ΒΡΈο÷ ΒΡΝΩ![]() ΘΜΉήΒΡKMnO4ΒΡΈο÷ ΒΡΝΩ
ΘΜΉήΒΡKMnO4ΒΡΈο÷ ΒΡΝΩ![]() Θ§‘ρ―θΜ·NOSO4HΒΡKMnO4ΒΡΈο÷ ΒΡΝΩ
Θ§‘ρ―θΜ·NOSO4HΒΡKMnO4ΒΡΈο÷ ΒΡΝΩ![]() ΓΘΗυΨίΜ·―ßΖΫ≥Χ ΫΘ§Ω…ΒΟΙΊœΒ Ϋ2KMnO4ΓΪ5NOSO4HΘ§‘ρNOSO4HΒΡΈο÷ ΒΡΝΩ
ΓΘΗυΨίΜ·―ßΖΫ≥Χ ΫΘ§Ω…ΒΟΙΊœΒ Ϋ2KMnO4ΓΪ5NOSO4HΘ§‘ρNOSO4HΒΡΈο÷ ΒΡΝΩ![]() Θ§NOSO4HΒΡ÷ ΝΩ
Θ§NOSO4HΒΡ÷ ΝΩ![]() Θ§NOSO4HΒΡ¥ΩΕ»
Θ§NOSO4HΒΡ¥ΩΕ»![]() ΓΘ
ΓΘ

ΓΨΧβΡΩΓΩœ¬Ν– Β―ιœ÷œσ”κ Β―ι≤ΌΉς≤ΜœύΤΞ≈δΒΡ «
Β―ι≤ΌΉς | Β―ιœ÷œσ | |
A | œρFe( NO3)2 ”κKSCN Ήι≥…ΒΡΜλΚœ»ή“Κ÷–ΒΈ»κ…ΌΝΩœΓ―ΈΥα | »ή“Κ―’…Ϊ≤Μ±δ |
B | œρœΓδεΥ°÷–Ά®»κΉψΝΩ SO2ΤχΧε | »ή“ΚΒΡ≥»…Ϊ÷πΫΞΆ »ΞΘ§Ήν÷’ΈΣΈό…Ϊ»ή“Κ |
C | œρ–¬÷Τ¬»Υ°÷–Φ”»κ…ΌΝΩ ·Μ“ · | »ή“ΚΒΡ«≥ΜΤ¬Χ…Ϊ÷πΫΞΆ »Ξ |
D | ΫΪ¥ρΡΞΙβΝΝΒΡ¬ΝΤ§Ζ≈÷Ο‘ΎΨΤΨΪΒΤΆβ―φ…œΦ”»» | ¬ΝΤ§÷πΫΞ»έΜ·ΒΪ≤ΜΒΈ¬δ |
A.AB.BC.CD.D
ΓΨΧβΡΩΓΩœ¬Ν– Β―ι≤ΜΡή¥οΒΫ Β―ιΡΩΒΡΒΡ «
A | B | C | D | |
Β―ι |
|
|
|
|
Β―ιΡΩΒΡ | Β―ι “÷Τ»ΓΑ±Τχ | ÷ΛΟς““»≤Ω… ΙδεΥ°Ά …Ϊ | Φλ―ι’αΧ«ΒΡΥ°Ϋβ≤ζΈοΨΏ”–ΜΙ‘≠–‘ | ÷ΛΟς»ήΫβΕ»ΘΚ |
A.AB.BC.CD.D