题目内容
【题目】下列分子中,属于非极性分子的是( )
A. SO2 B. BeCl2 C. CH3Cl D. COCl2
【答案】B
【解析】试题分析:A.SO2分子中S元素的最外层电子数为6,化合价为+4,最外层电子未全部成键,是极性分子,A不符合题意;B.BeCl2中含有极性键,空间结构为直线形形,正负电荷的中心重合,属于非极性分子, B符合题意;C.CH3Cl分子是四面体形结构,分子中C-H和C-Cl的键长、键能均不同,正负电荷的中心不重合,属于极性分子,C不符合题意;D.COCl2中心C原子成2个C-Cl键、1个C=O,不含孤电子对,为平面三角形,分子不对称,为极性分子,D不符合题意,答案选B。

【题目】铑基催化剂催化CO加氢合成甲醇(CH3OH)、乙醛(CH3CHO)、乙醇等碳的含氧化合物是近年来化学界比较活跃的研究课题之一。
(1)已知:(ⅰ)CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ/mol
CH3OH(g) △H1=-90.1kJ/mol
(ⅱ)2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5kJ/mol
CH3OCH3(g)+H2O(g) △H2=-24.5kJ/mol
(ⅲ)C2H5OH(g)![]() CH3OCH3(g) △H3=+50.7kJ/mol
CH3OCH3(g) △H3=+50.7kJ/mol
则由CO催化加氢制备乙醇气体(另一产物为水蒸汽)的热化学反应方程式为________。
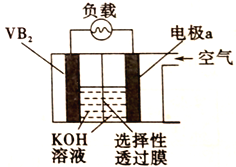
(2)直接甲醇燃料电池(DMFC)成本低、效率高,某研究所尝试用DMFC电解处理含氰电镀废水。调节废水pHl0~12.5,电解过程中,CNˉ先被氧化成CNOˉ(两种离子中氮元素均为-3价),再进一步氧化为碳酸盐和N2。
①请写出CNOˉ被氧化的电极反应式________。
②欲处理1m3CNˉ含量为390mg/L的电镀废水,至少需准备________kg甲醇。
(3)在2.0L密闭容器中放入1 molCO与2molH2,在反应温度T1时进行如下反应:
CO(g)+2H2(g)=CH3OH(g),反应时间(t)与容器内气体总物质的量(n)的数据见下表:
时间t/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
总物质的量n/mol | 3.0 | 2.7 | 2.5 | 2.3 | 2.1 | 2.0 | 2.0 |
①在0~5min时段,反应速率v(CH3OH)为________;有利于提高上述反应平衡转化率的条件是________。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
②计算温度T1时反应的平衡常数K1________;T1时达平衡后,改变反应温度为T2,平衡常数增大,则T2________T1(填“大于”“小于”),判断理由是________。