题目内容
13.下列关于有机物, 的叙述不正确的是( )
的叙述不正确的是( )| A. | 分子中9个碳原子可能位于同一平面内 | |
| B. | 该物质能使酸性KMnO4溶液褪色 | |
| C. | 1 mol该有机物可与4 mol H2发生加成反应 | |
| D. | 该物质能使溴水褪色是因为该物质将溴从其水溶液中萃取出来 |
分析 有机物含有碳碳双键,可发生加成、加聚和氧化反应,结合苯和乙烯的结构特点解答该题.
解答 解:A.苯环和乙烯具有平面形结构,与苯环直接相连的原子在同一个平面上,故A正确;
B.含有碳碳双键和甲基,都可被酸性高锰酸钾氧化,故B正确;
C.苯环和碳碳双键都可与氢气发生加成反应,则1 mol该有机物可与4 mol H2发生加成反应,故C正确;
D.含有碳碳双键,可与溴水发生加成反应,不能用于萃取剂,故D错误.
故选D.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的结构和官能团的性质,题目难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
3.关于如图所示装置的叙述,错误的是( )


| A. | 锌是负极,其质量逐渐减小 | B. | 氢离子在铜表面被还原,产生气泡 | ||
| C. | 电子从锌片经导线流向铜片 | D. | 电子从锌片经硫酸溶液流向铜片 |
8.自来水常用Cl2消毒,某学生用这种自来水去配制下列物质的溶液,不会产生明显的药品变质问题的是( )
| A. | AgNO3 | B. | Ca(OH)2 | C. | Na2SO3 | D. | AlCl3 |
18. 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,下列说法中正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,下列说法中正确的是( )
 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,下列说法中正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,下列说法中正确的是( )| A. | 从反应开始到第一次平衡时,N2的平均反应速率为0.005 mol•L-1•min-1 | |
| B. | 平衡在10 min至20 min的变化,可能是因为增大了容器体积 | |
| C. | 25 min时,分离出了0.1 mol NH3 | |
| D. | 在25 min后平衡向正反应方向移动,新平衡中NH3的体积分数比原平衡的小 |
5.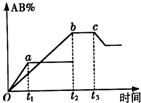 密闭容器中反应:A2+B2?2AB,产物AB的生成情况如图所示,a为500℃,b为300℃时的情况,c为300℃从时间t3开始向容器中加压的情况,下列叙述正确的是( )
密闭容器中反应:A2+B2?2AB,产物AB的生成情况如图所示,a为500℃,b为300℃时的情况,c为300℃从时间t3开始向容器中加压的情况,下列叙述正确的是( )
 密闭容器中反应:A2+B2?2AB,产物AB的生成情况如图所示,a为500℃,b为300℃时的情况,c为300℃从时间t3开始向容器中加压的情况,下列叙述正确的是( )
密闭容器中反应:A2+B2?2AB,产物AB的生成情况如图所示,a为500℃,b为300℃时的情况,c为300℃从时间t3开始向容器中加压的情况,下列叙述正确的是( )| A. | A2、B2、AB均为气体,正反应放热 | |
| B. | AB为气体,A2、B2中最少有一种为非气体,正反应吸热 | |
| C. | AB为气体,A2、B2中最少有一种为非气体,正反应放热 | |
| D. | AB为固体,A2、B2中最少有一种为非气体,正反应吸热 |
2.硫酸铁溶液水解可以得到一系列具有净水作用的碱式硫酸铁(xFe2O3•ySO3•zH2O),为测定某碱式硫酸铁的组成,取5.130g样品溶于足量盐酸中,然后加入过量的BaCl2溶液,经过滤、洗涤、干燥得白色固体5.825g,向上述滤液中加入过量的NaOH溶液,经过滤、洗涤、灼烧得到固体1.600g,该样品的化学式为( )
| A. | Fe2O3•2SO3•7H2O | B. | 4Fe2O3•10SO3•25H2O | ||
| C. | 3Fe2O3•6SO3•20H2O | D. | 2Fe2O3•5SO3•17H2O |
3.下列关于化学键的叙述,正确的一项是( )
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 单质分子中均存在化学键 | |
| C. | 含有极性键的分子一定是极性分子 | |
| D. | 含有离子键的化合物一定是离子化合物 |