��Ŀ����
����Ŀ���±�ΪԪ�����ڱ���һ����,�����г�10��Ԫ�������ڱ��е�λ��,�ش��������⡣
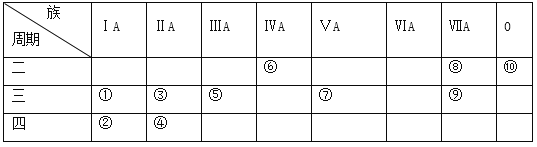
(1)��10��Ԫ����,��ѧ��������õ�Ԫ����____(д���),�õ���������ǿ��ԭ����____(��Ԫ�ط��ű�ʾ);Ԫ�آߵ�����������Ӧ��ˮ������______(д��ѧʽ)��
(2)Ԫ�آܵ����ӽṹʾ��ͼΪ____________________________��
(3)�١��ࡢ������Ԫ�ص������Ӱ뾶�ɴ�С��˳����(�����ӷ��ű�ʾ)_____________��
(4)���:
(��)�۵ĵ����û����ĵ��ʵĻ�ѧ����ʽ:___________________________��
(��)�ٺ͢�����Ԫ������������Ӧ��ˮ�������Ӧ�Ļ�ѧ����ʽ:__________________��
(��)�ں͢�����Ԫ������������Ӧ��ˮ�������Ӧ�����ӷ���ʽ:___________________��
���𰸡� �� F H3PO4  Cl->F->Na+ 2Mg+CO2
Cl->F->Na+ 2Mg+CO2![]() 2MgO+C Al(OH)3+NaOHNaAlO2+2H2O H++OH-H2O
2MgO+C Al(OH)3+NaOHNaAlO2+2H2O H++OH-H2O
����������Ԫ���ڱ��е�λ�ÿ�֪���١���ֱ�ΪNa��K��Mg��Ca��Al��C��P��F��Cl��Ne����
(1)����10��Ԫ���У���ѧ��������õ�Ԫ����ϡ������Ԫ��Ne���õ���������ǿ��ԭ����F��Ԫ�آߵ�����������Ӧ��ˮ������H3PO4��(2)�����ӽṹʾ��ͼΪ ��(3)Cl��FΪͬ����Ԫ���γɵ����ӣ�F��Cl����һ���ڣ��������Ӱ뾶��F��Cl��F��Na+��������Ų���ͬ����Na+�˵�������������Ӱ뾶��Na+��F����Cl��F��Na+��(4)þ�û���̼���ʵĻ�ѧ����ʽΪ2Mg+CO2
��(3)Cl��FΪͬ����Ԫ���γɵ����ӣ�F��Cl����һ���ڣ��������Ӱ뾶��F��Cl��F��Na+��������Ų���ͬ����Na+�˵�������������Ӱ뾶��Na+��F����Cl��F��Na+��(4)þ�û���̼���ʵĻ�ѧ����ʽΪ2Mg+CO2![]() 2MgO+C���ٺ͢�����Ԫ������������Ӧ��ˮ�����������ƺ������������Ӧ�Ļ�ѧ����ʽΪAl(OH)3+NaOH��NaAlO2+2H2O���ں͢�����Ԫ������������Ӧ��ˮ�����������غ��������Ӧ�����ӷ���ʽΪH++OH��H2O��
2MgO+C���ٺ͢�����Ԫ������������Ӧ��ˮ�����������ƺ������������Ӧ�Ļ�ѧ����ʽΪAl(OH)3+NaOH��NaAlO2+2H2O���ں͢�����Ԫ������������Ӧ��ˮ�����������غ��������Ӧ�����ӷ���ʽΪH++OH��H2O��

 ����ͬѧһ����ʦȫ�źþ�ϵ�д�
����ͬѧһ����ʦȫ�źþ�ϵ�д�