题目内容
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)(正反应为放热反应)是工业上制备硫酸的重要反应。下列叙述正确的是
2SO3(g)(正反应为放热反应)是工业上制备硫酸的重要反应。下列叙述正确的是
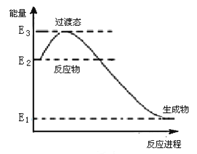
A. 2 mol SO3的总能量比2 mol SO2和1 mol O2的总能量要高
B. 催化剂V2O5不改变该反应的逆反应速率
C. 由于该反应是放热反应,所以降低温度会缩短反应达到化学平衡的时间
D. 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率v=(c2-c1)/(t2-t1)
【答案】D
【解析】
A.该反应是放热反应,二氧化硫与氧气的总能量高于三氧化硫的能量,A项错误;
B.加入催化剂,化学反应速率增加,B项错误;
C.降低温度,化学反应速率降低,达到平衡的时间更长,C项错误;
D.根据公式![]() ,SO3的反应速率为
,SO3的反应速率为![]() ;D项正确;
;D项正确;
本题答案选D。

练习册系列答案
相关题目
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)⑧的原子结构示意图为_________。
(2)②的气态氢化物分子的结构式为_____________。
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是________________。(填化学式)
(4)⑤、⑥元素的金属性强弱依次为___________。(填“增大”、“减小”或“不变”)
(5)④、⑤、⑥的形成的简单离子半径依次_______。(填“增大”、“减小”或“不变”)
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式:_______。