题目内容
在10mL 0.15mol·L-1 Fe2(SO4)3、10mL 0.2mol·L-1 KAl(SO4)2和20mL 0.3mol·L-1 (NH4)2SO4三种溶液中,分别加入足量的BaCl2溶液,所得沉淀质量依次为x g、y g、z g,则它们的关系为
- A.x>y>z
- B.z>y>x
- C.z>x>y
- D.x>z>y

 提分百分百检测卷系列答案
提分百分百检测卷系列答案某校研究性学习小组拟利用分光光度法对空气中二氧化硫含量(mg/m3)进行测定。分光光度法则是通过测定被测物质在特定波长时光的吸收度,对该物质进行定性和定量分析。其工作原理可以简单的用公式表示为A=kc,其中A为吸光度,k为一定条件下的常数,c为溶液浓度。
 实验步骤如下:
实验步骤如下:
⑴ 采样:
① 如果你是该小组成员,你对采样的地点和时间有何建议: 。
② 用右图装置采样,通过50L空气后,将吸收液移入100ml容量瓶,用少量吸
收液分两次洗涤吸收装置,合并洗涤液于容量瓶中,定容备用。用多孔球泡而不
用导管的原因是 。
⑵ 吸光度与SO2含量标准曲线的绘制:在6支25ml比色管中,用每毫升含25μg
二氧化硫的标准液配置下表标准SO2含量系列。
二氧化硫标准系列
| 管 号 | 0 | 1 | 2 | 3 | 4 | 5 |
| 标准液(ml) | 0 | 0.20 | 0.40 | 0.60 | 0.80 | 1.00 |
| 吸收液(ml) | 10.00 | 9.80 | 9.60 | 9.40 | 9.20 | 9.00 |
| 二氧化硫含量(μg) | 0 | 5.00 | 10.00 | 15.00 | 20.00 | 25.00 |
用10mL比色皿,以水为参比,测定各管吸光度,实验结果如下。
| 管 号 | 0 | 1 | 2 | 3 | 4 | 5 |
| 吸光度 | 0 | 0.20 | 0.40 | 0.60 | 0.80 | 1.00 |
 请在右图所示的坐标系中绘制标准曲线:
请在右图所示的坐标系中绘制标准曲线:
⑶ 准确量取容量瓶中溶液10mL加入比色皿,测得其吸光度值
为0.10,则空气中二氧化硫含量为 mg/m3。我国环境空气
质量标准中对每次空气质量测定中SO2的最高浓度限值(mg/m3):
一级标准:0.15;二级标准:0.50;三级标准:0.70。
则该市空气为 级标准。
⑷ 甲、乙两组同学测定结果相差较大,乙组同学测定空气中SO2
含量偏小,试分析乙组同学出现误差的可能原因: (两个所用
药品和装置均无问题)。
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.用于合成氨的工业煤气中含有H2S、C2H5SH(乙酸醇)、COS(羰基硫)、CS2等含硫化合物,工业上无机硫常用氧化锌法处理,有机硫可用钴钼催化加氢处理。
H2S+ZnO=ZnS+H2O;C2H5SH+ZnO=ZnS+C2H4+H2O
C2H5SH+H2=C2H6+H2S;COS+H2=CO+H2S;CS2+4H2=CH4+2H2S
(1)钴原子在基态时核外电子排布式为 。
(2)下列有关分子结构的说法正确的是 。
A.C2H4分子中有5个![]() 键处1个
键处1个![]() 键
键
B.COS分子(结构如右图)中键能C=O>C=S
C.H2S分子呈V形结构
D.CH4、C2H6分子中碳原子均采用sp3杂化
(3)下列有关说法不正确的是 。
A.H2O、CO、COS均是极性分子
B.相同压强下沸点:Cs2>COS>CO2
C.相同压强下沸点:C2H5SH>C2H5OH
D.相同压强下沸点:CO>N2
(4)![]() -ZnS的晶胞结构如右图,晶胞中S2-数目为: 个。
-ZnS的晶胞结构如右图,晶胞中S2-数目为: 个。
(5)具有相似晶胞结构的ZnS和ZnO,ZnS熔点为1830℃,ZnO熔点为1975℃,后者较前者高是由于 。
(6)钼的一种配合物化学式为:Na3[Mo(CN)8]·8H2O,中心原子的配位数为 。
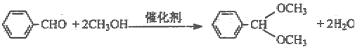
B.烃醛结合反应有机合成中颇为重要,绿色催化剂的固体铌酸酸倍受研究者关注。铌酸具有较高的催化活性及稳定性。反应原理如下:
实验方法是在25mL烧瓶中加入铌酸、10mL甲醇和 0.5mL苯甲醛,在回流状态下反应2h,反应的产率和转化率均非常高。
(1)采用回流反应2h的目的是 。
(2)在反应中甲醇需过量,其原因是 。
(3)不同铌酸用量对产率和转化率影响,如下表:
| 铌酸用量/mol | 0.01 | 0.02 | 0.03 | 0.05 | 0.1 | 0.15 | 0.2 | 0.6 |
| 产率% | 87.3 | 88.2 | 90.3 | 94.2 | 92.9 | 93.1 | 91.8 | 92.3 |
| 转化率% | 89.7 | 92.1 | 93.9 | 98.9 | 94.9 | 95.7 | 93.9 | 94.3 |
在上述苯甲醛与甲醇缩合反应实验中催化剂铌酸的最佳用量为 。
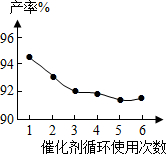
(4)催化剂的回收利用性能是考察催化剂的一项极为重要的指标。铌酸催化剂循环使用次数对产率的影响如右下图,这说明铌酸催化剂的优点之一是 。
(5)用铌酸作催化剂时,不同的醛与甲醇的缩合反应的转化率和产率如下表:
| 序号 | 醛 | 醇 | 转化率% | 产率% |
| 1 | 邻羟基苯甲醛 | 甲醇 | 94.3 | 89.6 |
| 2 | 邻羟基苯甲醛 | 甲醇 | 93.6 | 88.7 |
| 3 | 邻氯苯甲醛 | 甲醇 | 93.1 | 87.3 |
| 4 | 间硝基苯甲醛 | 甲醇 | 54.2 | 34.1 |
| 5 | 邻硝基苯甲醛 | 甲醇 | 89.9 | 79.5 |
| 6 | 对硝基苯甲醛 | 甲醇 | 65.7 | 41.9 |
从表中得出的不同的醛与甲醇缩合反应影响转化率和产率的规律是 。